ÚLTIMA HORA
EN DOLOR



XVIII CONGRESO SOCIEDAD ESPAÑOLA DEL DOLOR
Valencia • 26 - 29 octubre 2022
Entre el 26 y el 29 de octubre tuvo lugar en Valencia el XVIII Congreso de la Sociedad Española del Dolor.
Un congreso multidisciplinar y dinámico, en el que participaron más de 130 ponentes, que contó en su programa científico con 61 actividades con propuestas novedosas, que van encaminadas a que todos los profesionales sanitarios e investigadores tengan la mejor actualización en temas de dolor, tres cursos precongreso y siete talleres.
Entre otros temas, se abordó el impacto que tiene el dolor crónico en la salud mental de los pacientes (7 de cada 10 tienen ansiedad o depresión), el papel que están jugando las redes sociales para la información sobre
la salud y se hizo especial mención a la influencia del sexo y el género en el dolor.
Presentamos aquí una selección de las presentaciones que consideramos de mayor interés por su originalidad y actualidad.


ENTREVISTA
LA REALIDAD VIRTUAL, UNA HERRAMIENTA TERAPÉUTICA EN EL ALIVIO DEL DOLOR
HÉCTOR BELTRÁN ALACREU
Fisioterapeuta. Profesor Doctor en la Universidad de Castilla-La Mancha. Máster en el estudio y tratamiento del dolor.
La tecnología, los videojuegos y la realidad virtual se perfilan como una herramienta de demostrada eficacia en el alivio del dolor. Son muchas las investigaciones en curso para crear entornos tecnológicos que respondan a las necesidades de distracción frente al dolor, de incentivación de la movilidad y fomento del ejercicio que claramente proporcionan estas experiencias tecnológicas.
"La realidad virtual puede ser una herramienta útil en la lucha contra el dolor agudo y crónico."
NO DEJES DE VER ESTE VÍDEO PARA CONOCER DE PRIMERA MANO ESTAS NUEVAS HERRAMIENTAS

LA MITAD DE MIS PACIENTES INCUMPLEN LA TERAPIA ¿QUÉ HAGO?
La falta de adherencia es un grave problema y un auténtico reto que afecta a todas las enfermedades1,2. Su principal consecuencia es la disminución de la eficacia de los tratamientos prescritos2, provocando que los enfermos experimenten una pobre calidad de vida y malos resultados terapéuticos, además de aumentar considerablemente los costes sanitarios1.
Se estima que entre un 30% y un 50% de los pacientes crónicos presentan una mala adherencia, y este porcentaje podría ser incluso mayor en los países en vías de desarrollo1–3. Se trata de un serio problema que causa un aumento de morbilidad y mortalidad. Por ejemplo, en 2018, la mala adherencia a los tratamientos causó 125.000 muertes en Estados Unidos, y fue el motivo del 10% de las hospitalizaciones4.
Este problema afecta también a más del 40% de los pacientes de dolor crónico no oncológico, entre los que el 29,9% toma menos medicación de la prescrita, mientras que el 13,7% toma más2. Estas tasas de incumplimiento sugieren que la elección del tratamiento farmacológico debería contemplar el riesgo de falta de adherencia terapéutica2.
UN PROBLEMA POLIÉDRICO
La organización mundial de la salud (OMS) define la adherencia como el grado en que la conducta de una persona, ya sea tomando una medicación, siguiendo una dieta o realizando cambios en su estilo de vida, se ajustan a las recomendaciones recibidas del médico1. El término adherencia es el preferido actualmente, y hay que diferenciarlo del de cumplimiento (grado en el que el paciente se ajusta a las recomendaciones recibidas, pero de una forma pasiva) o del de retención, que hace referencia al número total de días en tratamiento frente a su duración planeada.

La mala adherencia puede ser intencionada, cuando el paciente decide por sí mismo, sin consultar a su médico, alterar la dosis o la posología del tratamiento o incluso suspenderlo. Esta decisión suele tomarse como consecuencia de las creencias del paciente, la aparición de efectos adversos o la percepción de falta de eficacia5. Estos factores se combinan en un análisis del riesgo-beneficio que realiza el enfermo basado en sus objetivos de tratamiento y su conocimiento de la medicación y de la enfermedad5.
Pero también puede ser no intencionada o influida por factores que están fuera del control del paciente. Estos van desde el coste de la medicación hasta la complejidad percibida o incluso los simples olvidos. La identificación de las variables o las barreras que influyen en la mala adherencia es fundamental para establecer las mejores intervenciones para mejorarla, mejorando los resultados terapéuticos5. Las variables, pueden agruparse en las categorías de factores socioeconómicos, relacionados con el sistema de salud, psicológicos, relacionados con el tratamiento, la aparición de efectos adversos, los inherentes a las creencias y comportamientos del paciente, el deterioro cognitivo y otras fuerzas externas.
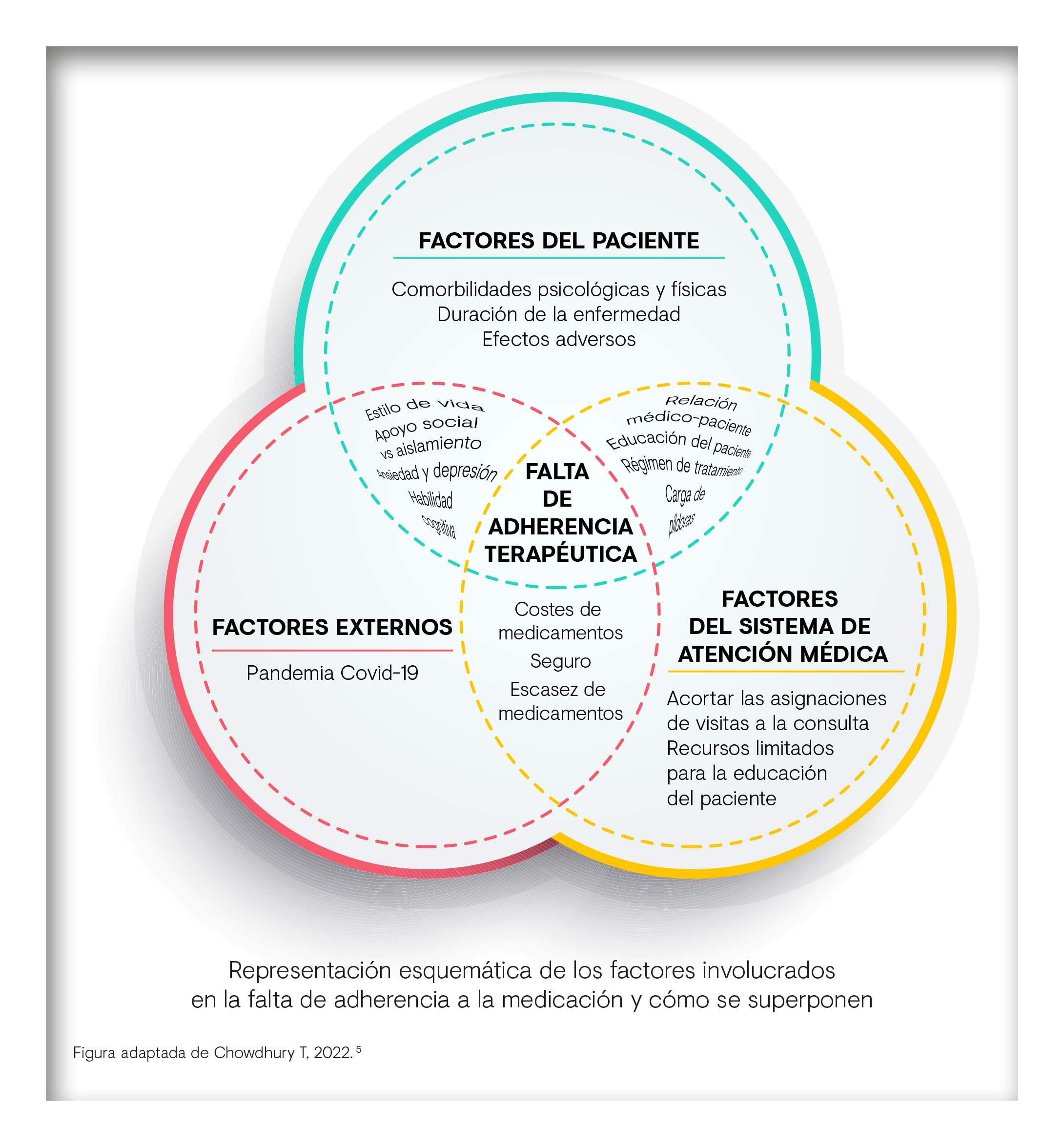
La situación económica de los pacientes es crucial para la adherencia. Por ejemplo, algunos estudios consideran que un 70% de los pacientes con artritis reumatoide no pueden cumplir la prescripción debido a su situación económica. Otro aspecto clave es la cobertura sanitaria de determinados tratamientos5.
Los sistemas de salud presentan una serie de características que pueden influir en la falta de adherencia a los tratamientos. Algunas de ellas son la relación médico-paciente, la información disponible y accesible sobre una enfermedad en particular o incluso, la escasez de determinados fármacos en la cadena de suministros. Una causa importante de la falta de adherencia es la escasez de información por parte del médico, de manera que el paciente tiene una concienciación inadecuada sobre la necesidad de un nuevo tratamiento o de los resultados que puede esperar5.
Los factores psiquiátricos desempeñan un importante papel en la adherencia. A pesar de ello, la literatura les presta una escasa atención6. Lo que está claro es que la ansiedad y la depresión impactan negativamente. Sin embargo, no está claro el impacto que tienen la capacidad de afrontamiento o el catastrofismo6.

El tratamiento por su parte también presenta características que influyen en la adherencia. Por ejemplo, los regímenes más complejos, con polimedicación, numerosas dosificaciones y especificaciones posológicas complicadas la reducen notablemente. Las creencias de los pacientes sobre los efectos adversos, o el beneficio percibido y el grado de comprensión de los beneficios esperables determinan la propensión de los pacientes a abandonar los tratamientos5. Una variable importante es la vía de administración y, sorprendentemente, las formulaciones orales presentan mayor riesgo para la falta de adherencia que las parenterales5.
En cuanto a los efectos adversos, su papel en la adherencia es crucial. Las ideas preconcebidas de los pacientes sobre los posibles efectos adversos pueden impactar en la adherencia incluso sin que hayan aparecido5.
Otras medicaciones para comorbilidades pueden presentar interacciones que contribuyen al aumento de los EA, empeorando la adherencia. En general, cuando los EA son graves o muy frecuentes los enfermos sienten que empeora la relación riesgo-beneficio, lo que les lleva a reducir dosis o a abandonar la medicación5.
Diversas características del paciente, como la edad y la situación funcional también influyen en la adherencia. En general, los ancianos son más adherentes que los jóvenes, probablemente porque tienen más tiempo libre y una rutina diaria mejor establecida. Además, su nivel de aceptación y adaptación a la enfermedad es mayor5. De la misma manera, los pacientes que viven solos suelen presentar menor adherencia. En cuanto al nivel educativo, las personas de menor nivel son más adherentes, lo que se asocia a que las personas de más educación tienen más capacidad de buscar y entender la información sobre la enfermedad y los posibles EA que pueden aparecer5.
Además de las causas descritas, hay una serie de variables externas que también impactan en la adherencia. Por ejemplo, en un estudio con 443 pacientes con artritis reumatoide que fueron monitorizados durante un año y medio, el 22% presentaron mala adherencia, principalmente por las frenéticas jornadas laborales (51%) aunque también por los frecuentes desplazamientos (26%) y por la complejidad de los regímenes de la medicación (16%)5.
¿CÓMO PODEMOS MEJORAR LA ADHERENCIA?
Comprender los complejos factores que están influyendo en la adherencia del paciente es, de lejos, el mayor paso en la dirección para mejorarla. Esta comprensión permitirá crear estrategias y planes específicos para cada paciente5. Además, hay que tener en cuenta que el tratamiento de las enfermedades crónicas requiere una adaptación psicológica y una reorganización conductual continuas que pueden afectar directamente al cumplimiento del tratamiento1.
La mejor opción es realizar la consulta de enfermos con dolor crónico con una orientación centrada en el paciente, con grandes dosis de escucha activa y usando un lenguaje sencillo. Es necesario explorar los errores de concepto que tengan los pacientes sobre su enfermedad y el tratamiento y tratar de corregirlos7.
Otro aspecto fundamental es identificar el riesgo de falta de adherencia analizando los factores comentados, y medir los niveles de adherencia del paciente. Para ello hay varias herramientas, como la información proporcionada por el propio enfermo o sus familiares, el control de retirada de fármacos de la farmacia o incluso otros medios más modernos como dispensadores de fármacos que controlan su uso y avisan de las nuevas tomas1,4.
Para mejorar la adherencia pueden utilizarse varias estrategias, en función del riesgo y la situación del paciente. Por ejemplo, se pueden utilizar técnicas de terapia cognitivo-conductual que buscan modificar las emociones, creencias y comportamientos que generan una imagen negativa acerca de la enfermedad y la terapia y modificarlas hacia un estilo de vida saludable y visiones más positivas sobre los tratamientos1,4.
Un ejemplo de estas técnicas es un trabajo realizado con pacientes diabéticos que asistieron a una consulta con una enfermera especializada en terapia cognitivo-conductual. La consulta, de 30 minutos, tenía dos partes. En la primera, se suscitó la motivación de los pacientes para tomar la medicación con regularidad. En la segunda, se pidió a los pacientes que planificara y pusieran por escrito en qué momento concreto tomarían la medicación1. También se utilizó un seguimiento telefónico para mantener la motivación.
Para promover la adherencia es fundamental la educación de los pacientes, sobre todo en lo referente a su enfermedad y su tratamiento, pero también en las consecuencias de la falta de adherencia. Sin embargo, aunque los programas de educación de pacientes mejoran su conocimiento, no parecen tener mucha eficacia sobre la adherencia, debiendo siempre usarse como parte de un programa más amplio que incluya otras técnicas1,4.
Otra estrategia útil es que el manejo del dolor crónico esté en manos de un equipo multidisciplinar. Esto tiene como primera consecuencia el mejorar la calidad de la asistencia sanitaria, y la calidad de vida de los pacientes, junto con su percepción y satisfacción sobre el cuidado recibido. La principal dificultad para esta intervención es la compleja organización de los sistemas de salud, que en ocasiones dificulta mucho la coordinación de los especialistas que atienden al paciente1.
También ha dado resultado involucrar a los pacientes en la gestión de su enfermedad, la conocida autogestión. Se trata de la capacidad del paciente, con la ayuda de su familia, de su entorno y de los profesionales de la salud para manejar los síntomas, tratamientos, gestionar cambios en su estilo de vida y las consecuencias psicosociales, culturales y espirituales de su enfermedad crónica1. En este tipo de intervenciones se recurre a recordatorios telefónicos, utilización de aplicaciones, páginas ‘web’, etc. para proporcionar al paciente conocimiento e información1,4. Precisamente, el uso de estas tecnologías ha demostrado una fuerte evidencia en cuanto a mejorar la adherencia1.
También hay que tener en cuenta el riesgo del tratamiento percibido por el paciente, que impacta fuertemente en la adherencia. Para resolverlo se usan técnicas de comunicación de riesgo, esto es, actividades educativas que buscan dotar al paciente de conocimiento suficiente para que tome decisiones correctas sobre su tratamiento. Para ello se emplean desde entregables en papel hasta aplicaciones ‘online’ que permiten que el paciente tome una decisión informada1.
No hay que olvidar la importancia de los recordatorios y el uso de envases adecuados así como de la reducción de la carga de comprimidos a tomar4. Su objetivo es que los pacientes no olviden acudir a sus revisiones, adquirir la medicación o tomarla. Hay varios métodos para estas intervenciones, desde llamadas telefónicas y otros tipos de tecnologías (SMS, web…) hasta el uso de envases especializados.
El uso de medios de comunicación para colaborar con el paciente en el manejo de la enfermedad tienen una eficacia ambigua en lo que se refiere a la adherencia, aunque un trabajo publicado en el que el personal de enfermería realizaba llamadas telefónicas a pacientes de HTA mostró una mejoría en la adherencia del 9%1.
En lo que hay más consenso es en que el uso de envase adaptados (pastilleros semanales, blíster calendario o incluso envases electrónicos con relojes y alarmas), tiene un efecto positivo en la adherencia y en los resultados clínicos del tratamiento1,4.
Como vemos las intervenciones para mejorar la adherencia son muy variadas y deben basarse en el nivel de riesgo del paciente. Sin embargo, aunque las intervenciones para mejorar la inadecuada adherencia no intencionada pueden realizarse de manera relativamente sencilla y generalizable (recordatorios, simplificaciones de dosis, educación…), la no adherencia intencionada es más compleja y requiere intervenciones adaptadas a cada paciente en las que es clave la valoración de los factores psicológicos asociados2.




SI EL MALESTAR QUE GENERA EL DOLOR ENTRA EN LA CONSULTA, HAY QUE PLANTARLE CARA
Especialistas e investigadores del campo de la Atención Primaria acaban de publicar un artículo en la revista científica British Journal of General Practice en el que ofrecen un esquema para el manejo de alteraciones del estado de ánimo relacionadas con el dolor. Según los autores, la comunidad médica “debe reconocer el impacto del dolor (musculoesquelético) persistente en el paciente y apoyarle, explorar cómo se siente de cara al futuro, fomentar el optimismo y ofrecerle estrategias de automanejo”.
Según los autores, el estado de ánimo decaído y el malestar son con frecuencia preocupaciones de los pacientes con dolor musculoesquelético, hasta el punto de que pueden encajar en la etiqueta de “depresión”. Consideran que es importante comprender cómo se aborda esta cuestión en las consultas de Atención Primaria. Por ese motivo, han explorado la perspectiva de los pacientes y sus médicos de cabecera en cuanto a malestar y depresión por dolor. Para hacerlo, han llevado a cabo un estudio cualitativo con pacientes que sufren estas condiciones y sus médicos en varios centros distribuidos por Reino Unido a partir de entrevistas semiestructuradas que después han evaluado con análisis de datos.
La mayor parte de los participantes declararon tener dificultades para distinguir la depresión y el malestar en el contexto del dolor persistente, pero también ofrecieron “pistas” para hacer esa distinción. Algunas personas contaron cómo reconocer su situación hacía que fuera más fácil enfrentarse a ella con optimismo (desde el punto de vista de los pacientes), mientras que los médicos admitieron que hay un “nihilismo terapéutico”, incluyendo incertidumbre sobre la causa del dolor y cómo manejar a los pacientes que lo padecen y en los que además hay una afectación del estado de ánimo en la consulta. Por el contrario, los médicos que identificaban y abordaban la cuestión con optimismo contaban que sus pacientes se sentían más optimistas e inclinados a hacerse con el control de la enfermedad.
LA RELACIÓN ENTRE ESTADO DE ÁNIMO Y DOLOR
Todos los participantes ofrecieron a los investigadores sus reflexiones sobre la estrecha asociación entre salud mental y dolor, que califican de condiciones “inseparables” cuando se trata de dolor persistente.
Los pacientes hablan del dolor como algo que afecta a “cada aspecto de su vida”. Una de las cosas que más les altera es la incertidumbre sobre cuánto durará o en qué momento se presentará. También preocupa mucho a los participantes el hecho de que los demás no les crean cuando cuentan qué les pasa.
Lo que los autores proponen es que el médico preste atención a posibles síntomas de afectación del estado de ánimo para que el paciente se sienta acompañado y sepa que hay estrategias para controlar el dolor. “Es clave que sientan que se atiende a su preocupación, que se distingue entre malestar y depresión, y que se le ofrecen terapias para aliviar su situación”, escriben.
Los autores admiten que sus recomendaciones llegan en un momento en el que la carga de trabajo en las consultas de Atención Primaria es grande, pero consideran que es más eficiente abordar el dolor en beneficio de los pacientes y del propio funcionamiento del sistema, ya que las complicaciones del dolor persistente y los problemas de salud mental sin tratamiento crean complicaciones significativas.


CANNABIS MEDICINAL. ACTUALIZACIÓN ASPECTOS LEGALES. ¿EN QUÉ SITUACIÓN NOS ENCONTRAMOS?
CANNABINOIDES EN EL USO TERAPÉUTICO
En España, la comercialización del cannabis para consumo está prohibida y penada según la ley 17/1967 de 8 de abril. Esta ley actualizaba las normas vigentes para adaptarlas al Convenio de Naciones Unidas de 1961, principal tratado internacional que conforma el marco legal internacional para el control de drogas1.
Desde 1972, año en el que España ratificó también el Convenio de la ONU sobre Sustancias Psicotrópicas, no se han producido avances en la ley. El código penal castiga como delito la posesión ilícita, el cultivo y tráfico del cannabis a pesar de su popularidad y laxa percepción en la sociedad de los riesgos asociados a su consumo. Por otra parte, cultivar cannabis es legal en España según el Real Decreto 1729/1999, si se contemplan una serie de normas como que las semillas estén certificadas y autorizadas por la Unión Europea, el porcentaje de THC (Delta-9-tetrahidrocannabinol) no supere el 0,2% en cada semilla y que el cultivo se dé en lugares privados, lejos del público.2
En las últimas décadas se han investigado los posibles beneficios del uso de los cannabinoides con fines terapéuticos (dolor crónico, glaucoma, isquemia cerebral, ciertos tipos de cáncer y enfermedades que cursan con alteraciones del movimiento)3.
El debate público sobre la regulación integral del cannabis llevó al Centro de Investigaciones Sociológicas a realizar un estudio demoscópico de ámbito estatal en 2021, donde un 90,1% de la población encuestada afirmaba estar a favor de uso terapéutico del cannabis y sus derivados4. Por este motivo, con fecha de 27 de mayo de 2022 se ha registrado una proposición de ley en el Congreso de los Diputados de España, que tiene como misión la creación de una ley de regulación integral del cannabis que pueda “garantizar y proteger los derechos colectivos, así como la realización de políticas en favor de la salud pública. Por lo tanto, debe establecerse un marco que elimine la estigmatización de las personas que optan por el uso de las sustancias derivadas de la planta del Cannabis sativa L. ya sea con fines recreativos o terapéuticas sin que esto suponga, en modo alguno, el fomento del mismo por parte de los poderes públicos. Tanto es así que la norma no permite el libre comercio de la sustancia psicoactiva derivada del cannabis, sino que está restringido a la venta en farmacia bajo prescripción facultativa, al autocultivo y a su obtención en clubes y asociaciones cannábicas.4”
CONTEXTO HISTÓRICO DE LA UTILIZACIÓN DE PREPARADOS DERIVADOS DE LA PLANTA CANNABIS SATIVA CON FINES TERAPÉUTICOS.
Pedanius Dioscórides (botánico, médico y escritor griego 50 a.C. y 70 a.C.) en su obra de farmacopea “De Materia Médica”, ya menciona el uso de la planta del "Kannabis" haciendo referencia al valor de la fibra de esta planta para hacer cuerdas y al de sus semillas para reducir el deseo sexual y en la preparación de una sustancia para tratar los gusanos del oído.
El poeta Ovidio hablaba en la “Historia de Glaucus”, de un hombre que comía hierbas verdes procedentes de una planta con hojas de palma produciéndole alegría, euforia y ataques de hambre.
En la Edad Media de la planta de cannabis se valoró más su uso como cáñamo para obtener fibra que cualquier otra de las propiedades de sus cogollos, ya que el clero prohibió sus usos y la población, que no estaba en contacto directo con el cannabis, olvidó los efectos psíquicos que producía. Tan sólo los alquimistas tenían acceso a ellos.
En España la primera referencia literaria al “hachís” se encuentra en la obra de Enrique de Villena, “Arte cisoria” (1423) y posteriormente en la obra "La Celestina" (Fernando de Rojas, S.XV) donde uno de sus personajes, Pármeno menciona la “yerva paxarera” entre los ingredientes de los aceites faciales usados por la trotaconventos.
En la Edad Contemporánea, es en el siglo XIX cuando se comenzaron a utilizar tinturas de cannabis para aliviar el dolor y las náuseas5.
A principios del siglo XX, se desarrollaron fármacos potentes que podían administrarse en dosis normalizadas por vía oral o mediante inyección, que resultaban más fiables y efectivos que los derivados del cannabis lo que produjo que los médicos dejaran de utilizarlos6.
La inclusión del cannabis en la Convención Única de 1961 sobre Estupefacientes como droga sin usos médicos puso fin a su uso con este fin en los países que lo ratificaron.
El uso recreativo que se extendió desde EEUU en 1970, reavivó interés por los usos médicos del cannabis. A los gobiernos les preocupaba transmitir un “mensaje equivocado” a los jóvenes si permitían el uso médico, y la clasificación ilegal del cannabis dificultaba la investigación de estos usos terapéuticos en EE.UU.
En 1990, el descubrimiento de un sistema cannabinoide en el cerebro hizo resurgir el interés por una posible utilidad médica del cannabis y sus derivados7. Se comenzaba a intuir que podrían ser de utilidad en el tratamiento del dolor crónico y trastornos neurológicos como la esclerosis múltiple y la epilepsia8.
CANNABIS SATIVA
Se denominan cannabinoides los compuestos psicoactivos presentes en una resina secretada a partir de las hojas y brotes florecidos de la planta Cannabis sativa. Esta planta contiene aproximadamente 400 compuestos químicos diferentes de los que unos 60 se consideran dentro del grupo de los cannabinoides9. Se clasifican en terpenos, flavonoides y fitocannabinoides. Los fitocannabinoides más abundantes en la planta son el cannabidiol (CBD) y el delta-9-tetrahidrocannabinol (THC).
El CBD no tiene efectos psicoactivos o psicotrópicos, por lo que no produce el efecto del “colocón”, mientras que el THC es el principal constituyente psicoactivo del cannabis. Según el Tribunal de Justicia de la Unión Europea (TJUE) en la resolución C-66318 conocida como el caso Kanavape :
- El CBD “no se encuentra incluido de forma explícita en el listado internacional ni en el de la UE de sustancias psicotrópicas”.
- El CBD “no demuestra tener efectos psicotrópicos o perjudiciales para la salud humana según datos de estudios científicos”.
- La actual prohibición del CBD “no debería afectar a la comercialización del CBD sintético que tuviera las mismas propiedades que el CBD extraído de la planta del Cannabis sativa en su totalidad”
Esta sentencia que concluye que “la prohibición del uso de CBD obtenido de la planta en su totalidad no es coherente, ni cumple el objetivo último de proteger la salud pública”, junto con el resultado de la votación del 2 de diciembre de 2020 en la Organización de Naciones Unidas (ONU) que instó al reconocimiento del potencial medicinal y terapéutico del cannabis, abre la puerta a que cannabis y la resina de cannabis sean excluidos de la Lista IV de sustancias peligrosas de la Convención Única de Estupefacientes, facilitando de esta manera la investigación científica de sus propiedades farmacológicas y su aprobación y comercialización bajo las normas de aprobación de un medicamento.
ESCENARIO ACTUAL DEL USO MÉDICO DE LOS CANNABINOIDES
En la actualidad hay países que permiten, o están trabajando para permitir, el uso terapéutico de los derivados del cannabis. Se presentan retos importantes a la hora de posicionar estos productos dentro de la variedad farmacológica que maneja el médico en su práctica diaria.
El reto de legislar según el tipo de producto final
Los países que se plantean autorizar preparados de cannabis para uso médico, han de considerar en qué compuestos será obligatorio o no equiparar la legislación del medicamento a estos compuestos:
- En primer lugar, los productos con una autorización de comercialización para uso médico, que supone que el producto se investigó en ensayos clínicos exhaustivos y que se evaluaron su seguridad, eficacia y efectos adversos. Las autoridades de registro sanitario también tienen en cuenta si el producto puede fabricarse con el nivel de calidad exigido. Este sería el caso de productos ya aprobados con las mismas garantías que cualquier medicamento como es el caso de Sativex (delta-9-tetrahidrocannabinol y cannabidiol) hasta ahora único aprobado en España como “tratamiento para la mejoría de los síntomas en pacientes adultos con espasticidad moderada o grave debida a la esclerosis múltiple (EM) que no han respondido de forma adecuada a otros medicamentos antiespásticos y que han mostrado una mejoría clínicamente significativa de los síntomas relacionados con la espasticidad durante un período inicial de prueba del tratamiento”.
- En segundo lugar, los preparados de cannabis. Productos derivados de la planta Cannabis sativa que pueden ser transformados por un farmacéutico en una fórmula magistral para consumo, de acuerdo con una prescripción médica específica. No tienen una autorización de comercialización para uso médico. Pueden incluir el cannabis crudo, aceites extraídos de la planta, los extractos de cannabis concentrados y otros preparados de cannabis, como geles blandos, tinturas o comestibles.
- En tercer lugar, los preparados de cannabis normalizados que procesados en gran volumen en fábricas tengan el carácter de complemento alimenticio o uso cosmético. No tienen una autorización de comercialización para uso médico.
En el caso de los preparados del cannabis las autoridades gubernamentales deben definir:
- ¿Quién puede prescribir, y quién no, estos compuestos (médicos, enfermeras, farmacéuticos)? ¿Se debe contemplar la objeción a la prescripción por motivos éticos o médico-legales?
- ¿Cuáles son las vías de administración, dosis y duración del tratamiento autorizadas según compuesto, patología y tipo de paciente?
- ¿Cómo afecta la legislación al cruce de fronteras con una medicación prescrita?
- ¿Cómo serán los mecanismos de farmacovigilancia y de control de uso adecuado de la medicación?
Aún parece largo el camino que lleve a un uso pautado y convencional de los derivados del cannabis con fines terapéuticos, debiendo investigarse con todos los controles para obtener la autorización de comercialización para uso médico. Hay que considerara que en la actualidad el desarrollo un producto farmacéutico innovador tarda una media de 10-13 años, en los cuales 1 de cada 10.000 compuestos llega a estar disponible para la prescripción y que la inversión media de la compañía farmacéutica es de 2.500 millones de euros por medicamento10.
POSICIONAMIENTO DE LA IASP y LA SED RESPECTO A LA UTILIZACIÓN DEL CANNABIS MEDICINAL EN EL TRATAMIENTO DEL DOLOR
La IASP (International Association for the Study of Pain) no respalda actualmente el uso generalizado del cannabis y de los cannabinoides en el alivio el dolor. Según documento publicado en 2021, las conclusiones de un panel de expertos identificaron importantes lagunas en la investigación sobre su eficacia y seguridad clínicas. Es necesario incrementar el estudio sobre la biología del sistema endocannabinoide y la realización de estudios preclínicos y clínicos que determinen los tipos de dolor y pacientes en los que puede ser eficiente, para el desarrollo de medicamentos eficaces y seguros.
La SED (Sociedad Española del Dolor) consciente del interés que despiertan la últimas investigaciones y avances legislativos internacionales sobre las diferentes aplicaciones del cannabis y los cannabinoides en el futuro tratamiento del dolor, suscribe el posicionamiento de la IASP.




Más allá del dolor
ENFERMEDAD DE KAWASAKI

En los primeros momentos de la pandemia de COVID-19 se pensaba que el SARS-COV-2 causaba una infección leve en los niños1. Sin embargo, con el avance de la enfermedad, en varios centros de Europa y Estados Unidos se detectó un nuevo síndrome inflamatorio multisistémico (SIM) en los niños infectados por SARS-COV-21. Los síntomas de esta nueva patología tenían un gran parecido con los de la Enfermedad de Kawasaki1, una entidad casi desconocida en nuestro entorno, pero de incidencia creciente en Japón y resto de países asiáticos2.
LA CAUSA MÁS COMÚN DE ENFERMEDAD CARDIACA ADQUIRIDA EN NIÑOS
La enfermedad de Kawasaki debe su nombre al pediatra japonés Tomisaku Kawasaki, quien en 1967 describió el primer caso de un raro síndrome ganglionar mucocutáneo febril agudo2. En la actualidad se describe como una vasculitis aguda autolimitada que afecta a vasos de pequeño y mediano calibre. Es la causa más común de enfermedad cardiaca adquirida en niños en los países desarrollados y la segunda causa de vasculitis en la infancia, después de la púrpura de Schönlein-Henoch3.
El seguimiento epidemiológico de la EK comenzó en Japón en 19702, comunicándose incidencias que aumentaban cada año hasta situarse en 2016 en 309 por cada 100.000 niños menores de 4 años (343.3 en niños y 273.2 en niñas)2. Sin embargo, se trata de una enfermedad mucho más prevalente en los países asiáticos (especialmente Japón) ya que en otros entornos la incidencia es más baja, situándose en 25/100.000 menores de 5 años en Estados Unido y de 5,4 a 15/100.000 menores de 5 años en Europa3.
En 2018 se desconocía su incidencia en España, pero los datos disponibles de Cataluña indicaban 8 por cada 100.000 menores de 5 años3. En cuanto a las edades, la máxima incidencia se sitúa entre los 18 y 24 meses de vida, y el 85% de los pacientes tiene menos de 5 años de edad3. Los niños la sufren 1,5 veces más que las niñas y, aunque es menos frecuente en menores de 3 meses o mayores de 5 años, estos grupos tienen mayor riesgo de desarrollar aneurismas de las arterias coronarias3. Se ha observado una mayor incidencia en los meses de invierno y primavera3.
No se conoce la tasa de letalidad de la EK, pero la mayor mortalidad se produce entre los 15 y 45 días desde el inicio de la fiebre, coincidiendo con la vasculitis coronaria y un estado de hipercoagulabilidad3.
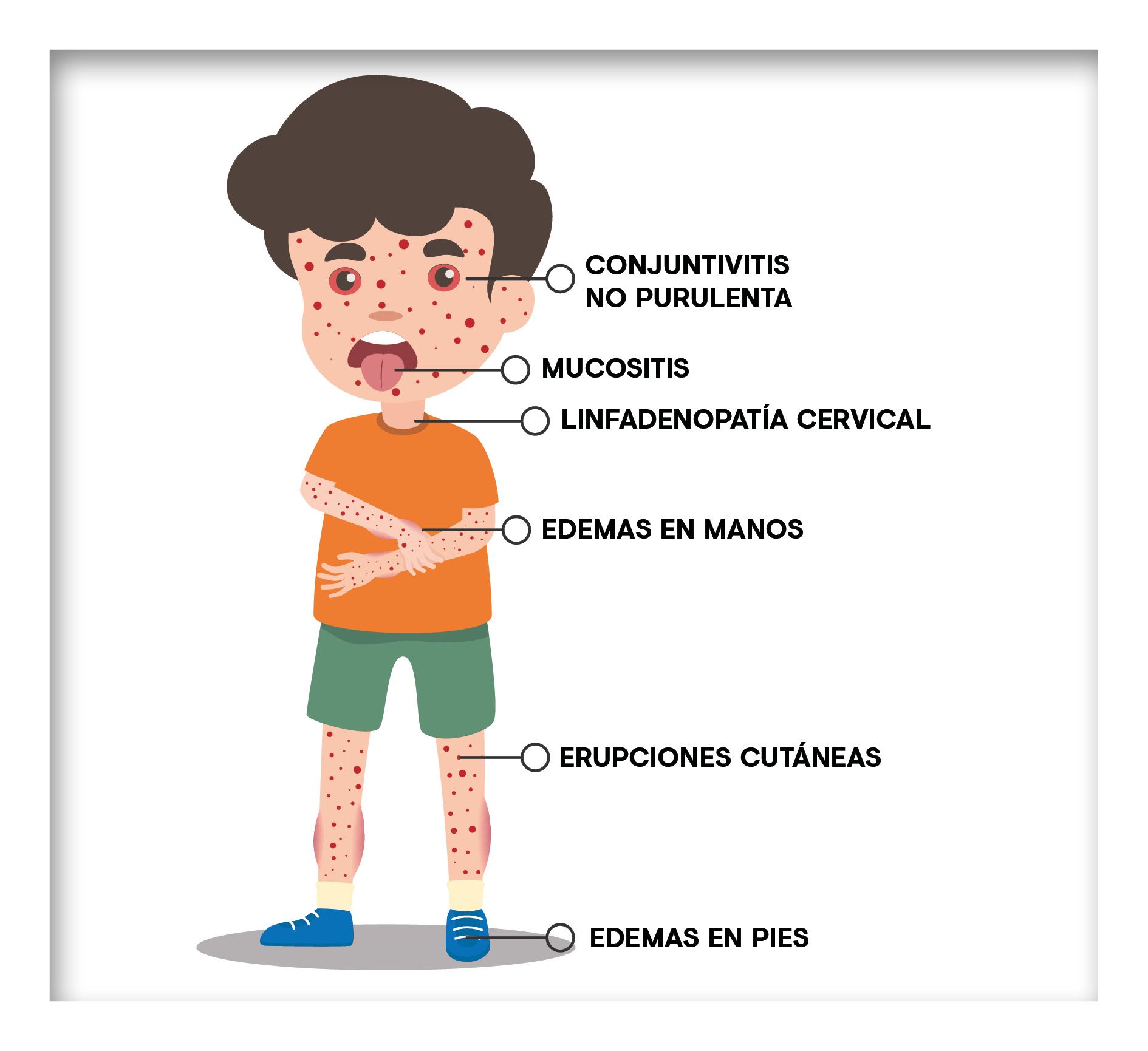
La enfermedad comienza con fiebre que dura más de 5 días. Los niños presentan además conjuntivitis no purulenta, erupciones cutáneas, edemas en manos y pies, mucositis y linfadenopatía cervical de más de 1,5 cm de diámetro, generalmente unilateral3,4.
Las causas de la EK son desconocidas, pero los hallazgos clínicos y de laboratorio, y las características epidemiológicas de la enfermedad sugieren un origen o desencadenante infeccioso, aunque aún no ha podido ser identificado2–4. Una hipótesis es que se trataría de una toxina medioambiental, posiblemente fúngica, transportada por vientos troposféricos que sería inhalada e infectaría los bronquios3.
La enfermedad no aparece en adultos, sugiriendo que estos son inmunes al agente infeccioso en cuestión. Tampoco aparece en menores de 6 meses, que estarían protegidos por la inmunidad materna a través de la lactancia3.
Por otra parte, la mayor incidencia en países asiáticos, en varones y el mayor riesgo entre hermanos apuntan a un posible factor genético relacionado con la EK2,3.
Otros autores sugieren que la hipótesis higiénica podría ser un factor de riesgo. Los entornos estériles, el exceso de antibióticos, los productos higienizantes y la alimentación con leche artificial podrían provocar una falta de maduración del sistema inmune. Esto explicaría la utilidad de las inmunoglobulinas en el tratamiento de la EK4.
Con todo esto, actualmente se admite que la EK podría estar causada por un algún tipo de agente infeccioso que produce la enfermedad en individuos genéticamente predispuestos, principalmente asiáticos3.
BENIGNA, PERO CON POSIBLES SECUELAS
En la evolución de la EK hay una primera fase aguda, con las reacciones inflamatorias descritas, que dura aproximadamente seis semanas. En la primera semana tras el inicio de la enfermedad se produce una arteritis coronaria, debida a la infiltración de la pared de las arterias por parte de células inflamatorias. Esta situación debilita la pared arterial, pudiendo dar lugar posteriormente a aneurismas coronarios2,3.
Aunque el proceso inflamatorio se resuelve espontáneamente en la mayoría de los pacientes, hasta un 25% de los que no reciben tratamiento presentan secuelas en las arterias coronarias2,3. En estos casos puede aparecer una forma crónica de la enfermedad, que dura meses e incluso años, en la que surgen lesiones de las arterias coronarias (LAC) que pueden ser letales. Además, aumentan el riesgo de los pacientes de padecer una arteriosclerosis futura, con el consiguiente riesgo de angina e infarto en la edad adulta2,3. Por tanto, la prevención de las lesiones de las arterias coronarias es clave para tener un buen pronóstico2.
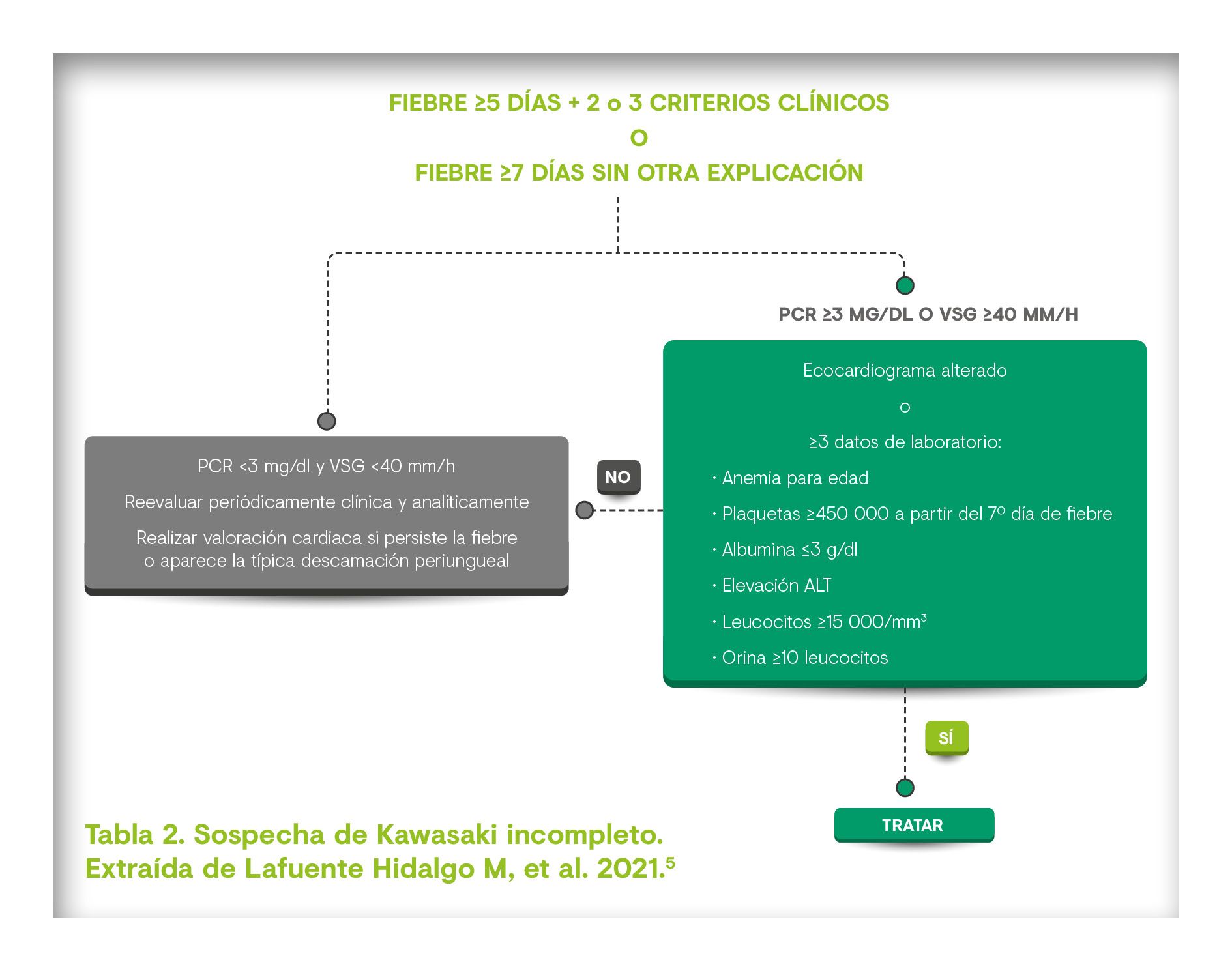
El riesgo de aparición de secuelas a largo plazo hace necesario que el diagnóstico sea lo más rápido posible, basándose en criterios clínicos. En general, hay que sospechar en niños de hasta 5 años que presentan fiebre prolongada inexplicable, y al menos uno de los 5 criterios mencionados (conjuntivitis no purulenta, erupciones cutáneas, edemas en manos y pies, mucositis y linfadenopatía cervical)3,4. Los indicadores de inflamación en las pruebas de laboratorio apoyan el diagnóstico3.

La identificación de aneurismas coronarios también confirma el diagnóstico, aunque no suele detectarse en la primera semana de la enfermedad. La afectación cardiaca puede aparecer en forma de inflamación en el pericardio, miocardio, endocardio y arterias coronarias. La arteritis puede ser necrosante, dando lugar a debilitamiento de la pared y la aparición de aneurismas. En ocasiones hay una proliferación celular en la pared de los vasos, originando estenosis. Todas estas afectaciones son la principal causa de morbimortalidad de la EK, tanto en la fase aguda como a largo plazo3.
Para el diagnóstico de la afectación cardiaca son útiles la ecografía y la ecografía transesofágica, quedando para los casos más complicados la coronariografía, la RMN cardiaca y el TAC. Por supuesto, ciertos cambios en el ECG pueden indicar afectación miocárdica o coronaria3.
TRATAR PARA PREVENIR
El objetivo del tratamiento es prevenir las lesiones de las arterias coronarias (LAC)2–4. El manejo estándar para la EK aguda es el ácido acetilsalicílico (AAS) junto con inmunoglobulina intravenosa (IGIV)3,4 ya que, aunque se desconoce su mecanismo de acción, su eficacia en la reducción de la prevalencia de los aneurismas coronarios ha sido ampliamente demostrada2,3. Debe administrarse tan pronto como sea posible en los 10 primeros días de la enfermedad3.
Entre un 10 y un 20% de los pacientes tienen fiebre persistente 36 horas después de la administración de IGIV, es decir, son resistentes al tratamiento y son los que presentan mayor riesgo de desarrollar LAC2,3. Para estos pacientes se han utilizado una serie de tratamientos que suelen mejorar la inflamación, pero que no han demostrado evitar las secuelas cardiacas2. Además, en caso de inestabilidad hemodinámica se añaden agentes inotrópicos y vasopresores al tratamiento convencional con IGIV3.
Los fármacos usados en segunda línea van desde infliximab2-4, que es eficaz en disminuir la inflamación pero sin efecto sobre la vasculitis3, a una segunda dosis de IGIV o corticoides2,3. Más recientemente se han usado ciclosporina por su efecto inmunosupresor y anakinra, un novedoso inhibidor de la IL-1 en los pacientes que son altamente refractarios al tratamiento convencional2,3.
Tras la recuperación de la fase aguda de la EK, se recomienda terapia antiplaquetaria durante al menos dos meses, ya que la actividad plaquetaria y el aumento de la coagulación pueden prolongarse 2 o 3 meses tras el diagnóstico. En estos casos puede usarse AAS con precaución2.
Los pacientes que no presentaron LAC no necesitan mayor seguimiento y pueden llevar una vida normal sin restricciones2. Sin embargo, en los pacientes que sí la presentaron, es necesario el uso de AAS y otros antiagregantes y anticoagulantes, especialmente si se ha producido infarto o aneurismas gigantes. También es conveniente la adición de una estatina y un inhibidor de los receptores de angiotensina II (ARAII), por su utilidad en la salud cardiaca general2.
Cuando hay secuelas cardiacas de la EK debe realizarse un seguimiento de por vida, ya que por ejemplo en Estados Unidos, el 5% de los infartos agudos de miocardio (IAM) en pacientes menores de 40 años ocurren en personas con historia conocida o sospecha de EK, mientras que en Japón, hasta el 9% de los IAM o muerte súbita cardiaca en adultos jóvenes son atribuibles a antecedentes de EK2,3. Por esto, la Asociación Americana del Corazón (American Heart Association AHA) recomienda una cuidadosa transición de los pacientes con antecedentes de EK a la cardiología de adultos entre los 18-21 años3.
¿ES EL SARS-COV-2 EL AGENTE INFECCIOSO BUSCADO?
En la reciente pandemia se ha observado que varios niños diagnosticados con COVID-19 habían desarrollado síntomas similares a los de la enfermedad de Kawasaki, es decir, el síndrome inflamatorio multisistémico en niños (SIM)2.
Se trata de un síndrome hiperinflamatorio que afecta a múltiples órganos y que se desencadena por la infección por SARS-COV-2 y que suele aparecer entre 2 y 4 semanas después de la infección. Su tratamiento es similar al propuesto para la EK, respondiendo los pacientes al uso de IGIV. Sin embargo, los mecanismos inmunitarios adaptativos son la clave en la patogénesis del SIM y aunque los síntomas de ambas enfermedades se solapan, parecen ser dos entidades clínicas totalmente distintas1.
A pesar de su popularidad reciente por la aparición de un síndrome similar en niños enfermos de Covid-19, el SARS-COV-2 no parece ser el causante de la EK. Sin embargo, la EK es una patología de incidencia creciente, principalmente en países asiáticos y especialmente en Japón, que merece la atención de los clínicos, ya que puede ser causa de importantes secuelas cardiacas, incluso fatales.
Actualmente se desconoce su causa y, aunque los tratamientos disponibles reducen la sintomatología y las secuelas de manera importante, aún hay un 20% de los pacientes que sufrirán sus consecuencias de por vida, y que necesitarán un seguimiento constante, por lo que son necesarios nuevos tratamientos para mejorar la vida de estos pacientes.


OPTIMUS: EL CORRECTO ABORDAJE DEL PACIENTE CRÓNICO
En el paciente crónico es clave un correcto abordaje integral de su patología que asegure que su tratamiento cumple con una adecuada posología, duración y dosificación, facilitando la adherencia y consiguiendo así alcanzar el objetivo terapéutico fijado.

CONGRESOS Y JORNADAS
Consulta todos los congresos, jornadas, eventos y reuniones especializados en dolor.








