ÚLTIMA HORA
EN DOLOR


ARTÍCULO
DOLOR ONCOLÓGICO EN ATENCIÓN PRIMARIA
Con frecuencia, el dolor es el primer síntoma del cáncer, aunque puede presentarse durante cualquier fase de la enfermedad. Se trata de un síntoma frecuente y prevalente que afecta al 39% de los pacientes tras el tratamiento, el 55% lo padecen mientras reciben quimioterapia o radioterapia y hasta un 66% de los pacientes con cáncer avanzado presentan dolor1–3. Además, se sabe que el dolor crónico es una consecuencia común de los tratamientos contra el cáncer y, si no se trata, tiene un impacto considerable en la calidad de vida de los supervivientes4.
La presencia y la gravedad del dolor tienen importantes implicaciones clínicas que pueden influir negativamente en los resultados del enfermo. Un mal control del dolor también se asocia con mayor malestar psicológico, disminución de las actividades sociales y menor apoyo social1,2. Por tanto, un manejo adecuado del dolor en estos pacientes, es fundamental para mejorar su calidad de vida y sus resultados en salud2.
Sin embargo, el dolor oncológico sigue sin recibir la atención adecuada. Un estudio sistemático mostró que, a pesar de que su infratratamiento disminuyó un 25% entre 2007 y 2013, actualmente un tercio de los pacientes con cáncer aún no reciben un tratamiento adecuado para el dolor2.
Debido al crecimiento de la prevalencia del cáncer, los oncólogos del futuro se verán desbordados, y sin tiempo para manejar adecuadamente el dolor4. Por ello, todos los clínicos que atienden pacientes con cáncer deberían conocer cómo abordarlo de manera efectiva2.
La concienciación es la primera barrera
Una encuesta nacional realizada entre oncólogos de EEUU mostró que desconocían su capacidad real de manejo del dolor en sus pacientes, ya que evidenció una discrepancia entre lo que creían conocer y cómo respondieron a un caso clínico de muestra2. Esta encuesta también reveló que la mediana de tiempo que dedicaban anualmente a la educación sobre el tratamiento del dolor era de aproximadamente 1,3 horas2.
Los oncólogos no siempre entendían los principios comunes del tratamiento del dolor, como la titulación equianalgésica de las dosis de opioides, o las diferencias entre pseudoadicción, tolerancia, dependencia fisiológica o trastornos por consumo de sustancias2. Sin embargo, con frecuencia la intensidad del dolor en los pacientes con cáncer hace necesario el uso de opioides para su control. Es fundamental, por lo tanto, que los oncólogos, y el resto de clínicos que atienden a los pacientes con cáncer, reciban formación adecuada sobre el uso seguro y efectivo de los opioides en los casos de dolor oncológico
Pero también existen otros obstáculos para el tratamiento de dolor oncológico. En este sentido, aunque desde 1999 se consideró el dolor como el 5º signo vital, en 2006 los datos mostraban que este criterio no había cambiado la calidad del manejo del dolor, por lo que en 2016 la Asociación Médica Americana retiró su recomendación de monitorizar el dolor como un signo vital2.
Las creencias de los pacientes también pueden plantear obstáculos. Por ejemplo, pueden rechazar el tratamiento por asociarlo a actuaciones paliativas, a la progresión de la enfermedad o por las connotaciones sociales de los opioides mayores2,3.
Tampoco hay que despreciar los obstáculos económicos ya que, en algunos sistemas sanitarios, el coste del tratamiento del cáncer es muy elevado2.
Todas estas circunstancias hacen que el abordaje del dolor oncológico, especialmente el avanzado, o incluso el refractario constituyan un reto, no sólo médico, sino también ético3.
Un problema con muchas formas
La clasificación fisiopatológica habitual del dolor (somático, visceral y neuropático) se complica en el dolor oncológico, donde los pacientes padecen varios tipos de dolor en función de su origen o su duración3.
Por ejemplo, el dolor basal es un dolor continuo que precisa una medicación pautada, no a demanda. Por lo general la dosis es progresiva y puede existir la necesidad de administrar dosis “de rescate” para su control, o fármacos adyuvantes si se reactiva3. Luego están las crisis de dolor irruptivo, o exacerbaciones transitorias , sobre el dolor basal que ha sido controlado con la medicación pautada3.
A su vez, el dolor irruptivo puede ser incidental, cuando la causa desencadenante es conocida (algún movimiento o actividad concreta) y que se debe “prevenir” con dosis extra de analgesia. Aparece hasta en un 65% de los pacientes terminales. Pero el dolor irruptivo también puede ser espontáneo, que no tiene un desencadenante conocido y que no obedece a un patrón. Se usan analgesias de acción rápida para que exista el menor tiempo posible de latencia entre la toma y el efecto analgésico3.
El dolor también puede deberse a un fallo de final de dosis y aparecer cuando, tras un tiempo variable bajo control, el paciente indica que aparece dolor antes de la siguiente toma de analgésico. Sería necesario aumentar la dosis del tratamiento basal o reducir el espacio entre dosis3.
También hay un tipo de dolor que aparece debido a los tratamientos anticáncer, se trata del dolor iatrogénico. Por ejemplo, la radioterapia causa radiodermitis, mucositis o dolores neuropáticos, mientras que la quimioterapia causa mucositis y dolores neuropáticos3. Estos últimos son frecuentes en la quimioterapia con cisplatino, taxanos y alcaloides de la vinca, que producen neuropatía periférica dolorosa con disestesias, sensación de quemazón en los pies y manos y alteraciones en la sensibilidad vibratoria y propioceptiva3.
Hasta un 15% de los pacientes presentan dolor refractario al tratamiento con opioides, y su diagnóstico es fundamental, ya que es muy común que origine una errónea orientación terapéutica3.
En cualquier caso, podemos decir que el dolor oncológico es un dolor total, ya que actúa negativamente sobre la salud física y mental del paciente, afectando a su capacidad funcional, recursos económicos y a su ambiente social. Su abordaje debe ser multidisciplinar y continuado y debe intentar abordar todas las esferas que se ven afectadas por el cáncer3.
La clave está en la evaluación
El manejo del dolor oncológico comienza con una evaluación integral, de la intensidad del dolor, su etiología y su fisiopatología. También de lo que el paciente describe como intensidad del dolor objetivo y su impacto funcional2.
Las fluctuaciones en los patrones de dolor son muy importantes (cuál es la intensidad mayor, la menor y el promedio en la última semana) junto con la respuesta al tratamiento analgésico durante un periodo de tiempo razonable2. Para ello se recurre al relato del paciente, los diarios de dolor o, mejor aún, a ambos2.
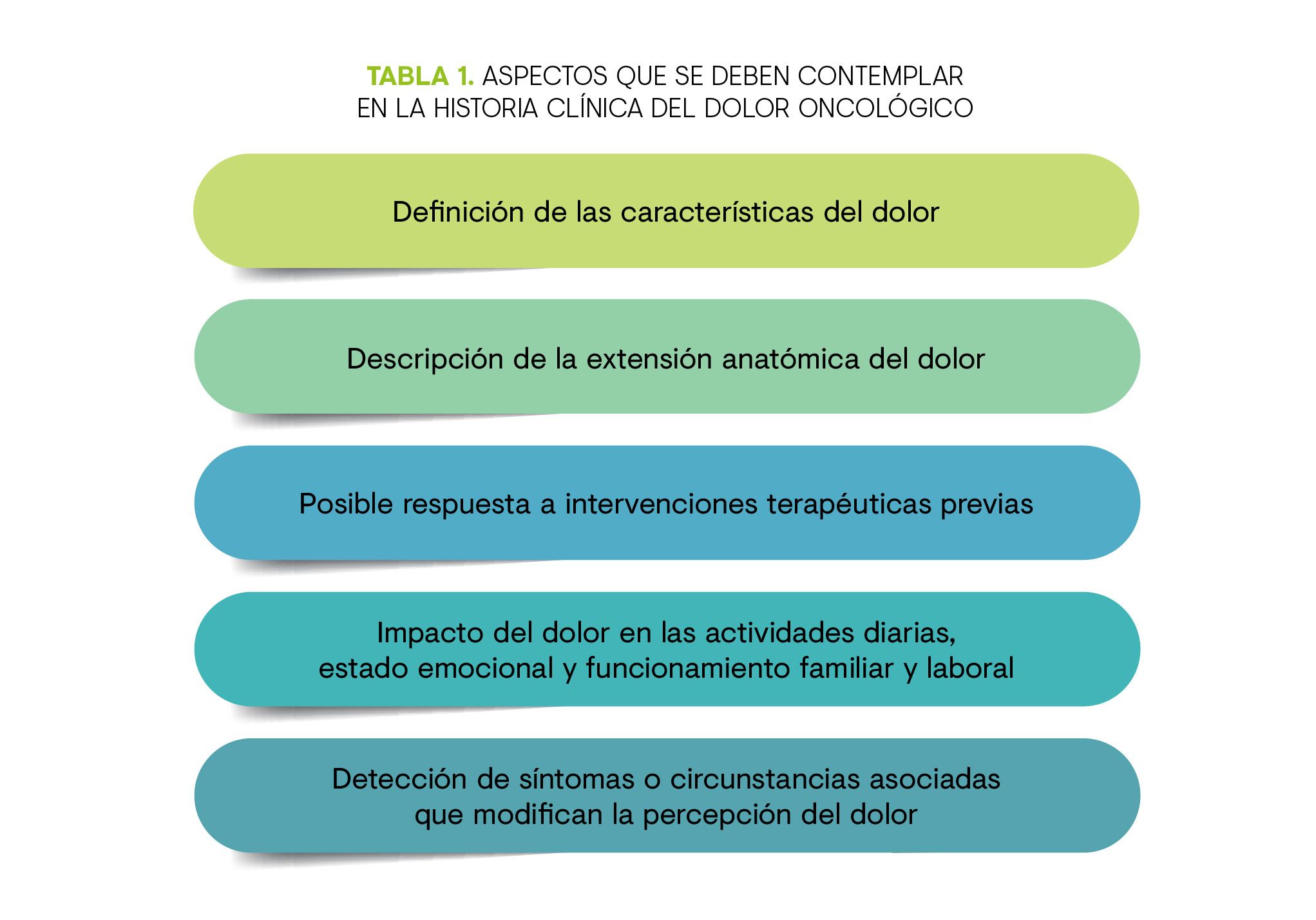
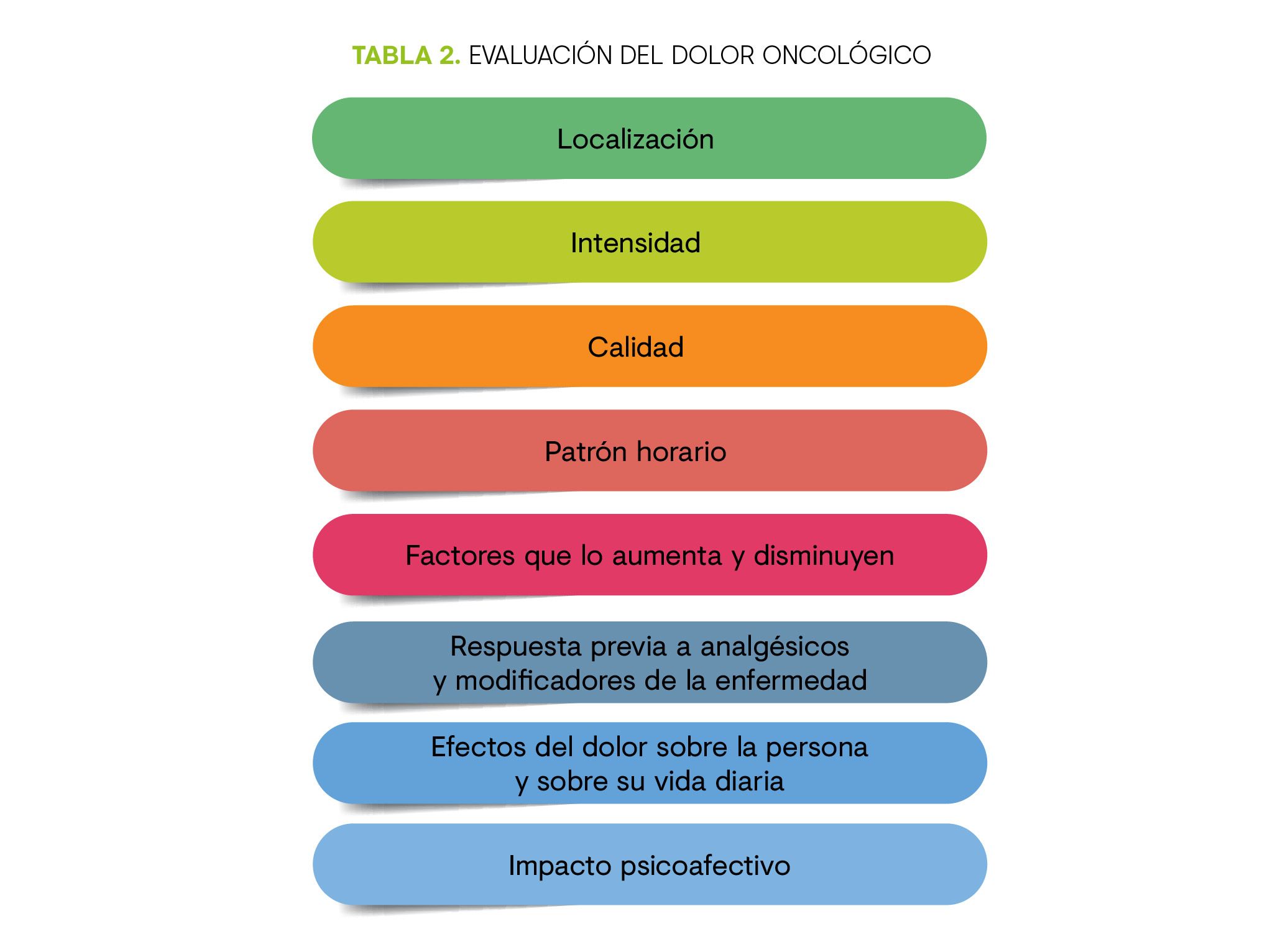
La mayoría de los dolores que no están relacionados con una emergencia oncológica (compresión de la médula espinal, fractura inminente, síndrome de vena cava superior, etc.) pueden tratarse eficazmente en el ámbito ambulatorio2.
La escalera y el dolor
Es aconsejable manejar el dolor con un plan analgésico multimodal para lograr un control óptimo y una mejor calidad de vida de los pacientes con cáncer1,2. Uno de los primeros pasos en el manejo es establecer expectativas adecuadas, así se consigue una mayor satisfacción y adherencia al tratamiento2.
El tratamiento se guía por la “Escalera Analgésica de la OMS” en la que la elección del analgésico se determina por la intensidad del dolor2,3:
En su primer escalón se usarían analgésicos básicos, generalmente de venta sin receta (paracetamol, algunos AINE...). En el segundo escalón entrarían los considerados opioides débiles como el tramadol y la codeína y los opioides más potentes se usarían en el tercer escalón2.
Muchos clínicos reciben poca información sobre cuándo o cómo rotar de manera segura los opioides, incluido el cálculo de dosis equianalgésicas. Muchos efectos adversos que ocurren al inicio o ajuste de dosis son limitados en el tiempo, por lo que no deberían desencadenar una rotación de tratamientos2.
También se usan los llamados adyuvantes analgésicos, que son medicamentos que pertenecen a diferentes grupos farmacológicos y que se asocian a los analgésicos en el tratamiento del dolor oncológico, sobre todo si concurren otros tipos de dolor, o predomina el componente neuropático3.
Recientemente se ha añadido un nuevo escalón que recuerda a los clínicos la conveniencia de considerar intervenciones no farmacológicas como opciones de manejo2. Entre estas se encuentran la radioterapia (el 50% de la utilizada se considera paliativa) y algunas intervenciones quirúrgicas como la analgesia epidural/intratecal, bloqueos nerviosos etc2,3.
Últimamente también ha ganado auge la medicina integrativa, sobre todo por el interés mostrado por los pacientes. Se estima que hasta un 31% de los enfermos de cáncer usan acupuntura. Otra disciplina interesante es el ‘mindfulness’, ya que teniendo en cuenta el número y la complejidad de los factores que influyen en el bienestar general del paciente, podría ser una herramienta importante, junto con el tratamiento farmacológico, ya que hay evidencia de su influencia positiva en los biomarcadores asociados al estrés2.
Cuando el dolor se debe a la carga tumoral o a fracturas, puede esperarse que la aplicación de la escalera analgésica lo mejoren. Sin embargo, los dolores neuropáticos responden de manera diferente.
El dolor en los supervivientes del cáncer
El dolor en los supervivientes del cáncer puede indicar la aparición de recurrencias, lo que requeriría una evaluación completa, incluyendo pruebas de imagen. Sin embargo, en los supervivientes que desarrollan dolor en ausencia de neoplasias activas, el manejo debe ser similar al de pacientes con dolor crónico sin historia de cáncer2.
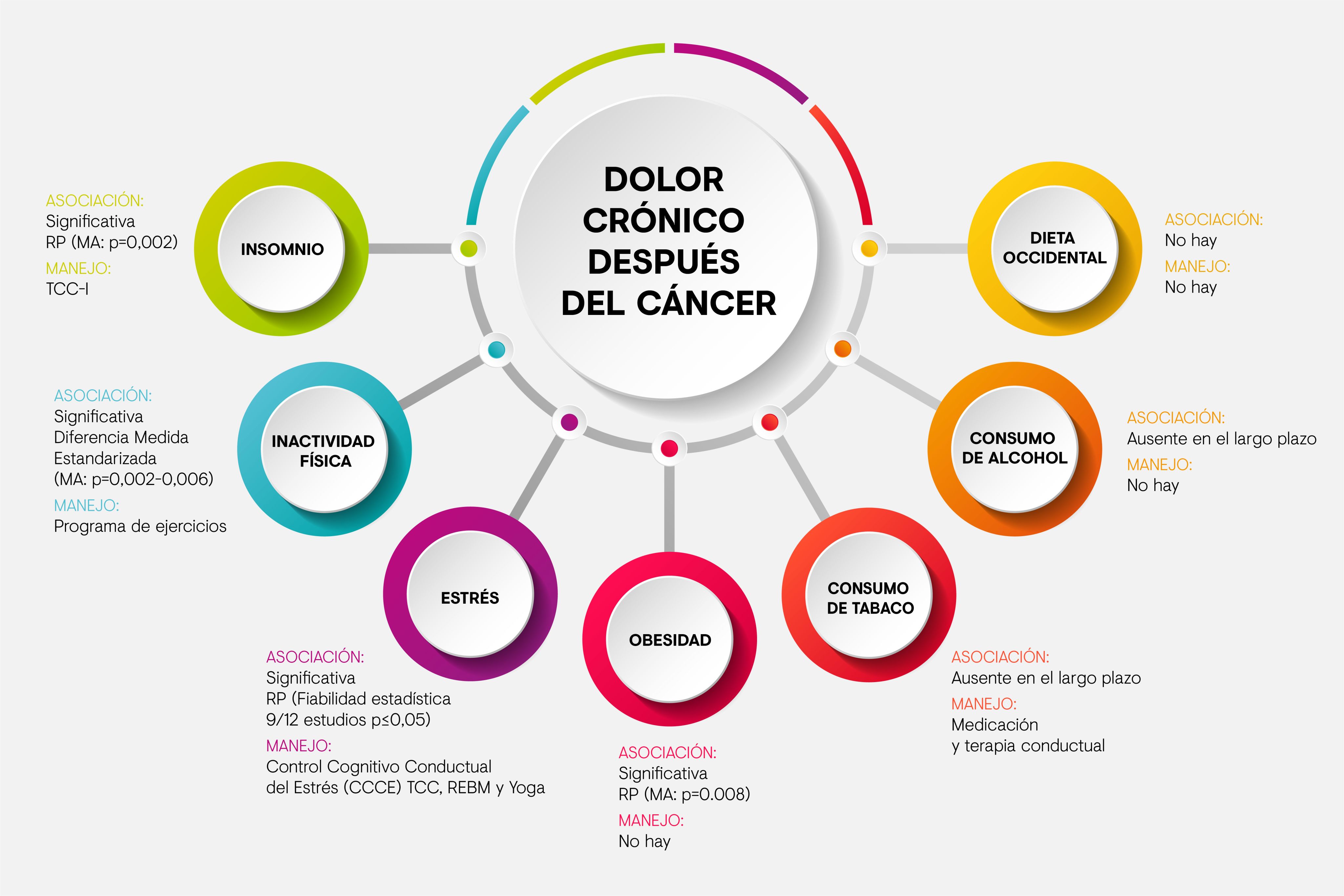
Figura 1. Evidencia de factores de estilo de vida modificables que contribuyen al dolo crónico en supervivientes de cáncer. Adaptada de Lahousse A, et al. 20214. Abreviaturas: TCC(-I) Terapia Cognitiva Conductual (insomnio). CCCE: Control Cognitivo Conductual del Estrés. MA: Meta-análisis; REBM: Reducción del Estrés Basado en Mindfulness; RP: Razón de Probabilidad.
Sin embargo, con frecuencia los supervivientes encuentran difícil recibir un tratamiento adecuado para su dolor crónico4. Por ello, la formación de los clínicos es clave. En estos pacientes es fundamental identificar los factores que facilitan la cronificación del dolor, sobre todo los factores psicosociales y de estilo de vida, que sean modificables.
Entre estos se encontrarían el estrés, que puede ser manejado por Terapia Cognitivo Conductual (TCC), yoga… También el insomnio que forma un círculo vicioso con el dolor. La obesidad, el tabaquismo y el consumo excesivo de alcohol tienen un claro impacto en la salud general.
Por otro lado, la actividad física ha demostrado tener un impacto positivo en la salud. lamentablemente, la adherencia es baja y sería necesario el desarrollo de nuevas estrategias que aumenten la motivación de los pacientes para mejorar los resultados a largo plazo4.




ENTREVISTA
LA VOZ DEL DOLOR CRÓNICO

LEONOR Mª PÉREZ VEGA, Doctora en Derecho de la Universidad de Valladolid, e ISABEL LÓPEZ RAMOS, Abogada y Miembro Fundador del Proyecto Solidario “Pan y Pepinillo” (Plataforma de Pacientes con Dolor Crónico), ponen voz a los 8 millones de personas que sufren dolor crónico en España.

ARTÍCULO
¿SABÍAS QUE LA OBESIDAD PUEDE DOLER?
El gran problema de la obesidad
Desde 1975 se ha dado un crecimiento alarmante de la obesidad a nivel mundial, y la OMS alerta de que hasta 2016, la prevalencia se había triplicado. Y ha seguido creciendo hasta nuestros días. Paradójicamente, ha sido la mejoría de las condiciones de vida, con el aumento de la ingesta de alimentos de alto contenido calórico y el descenso de la actividad física debido a formas de trabajo cada vez más sedentarias, la que ha causado el asombroso crecimiento de la obesidad en todo el mundo1.
La situación es tan alarmante que, a nivel mundial, el sobrepeso y la obesidad están relacionados con un mayor número de muertes que el peso insuficiente. En general, hay más personas obesas que con peso inferior al normal, y esto sucede en todas las regiones, salvo en partes de África subsahariana y Asia1. Según datos de la OMS, en 2016 más de 1900 millones de mayores de 18 años tenía sobrepeso, de los que 650 millones eran obesos1. Algunos estudios apuntan que, con la tendencia actual, hacia 2030 el 58% de la población mundial podría ser considerada obesa o con sobrepeso3.
El riesgo de contraer enfermedades no transmisibles (como las enfermedades cardiovasculares, la diabetes, los trastornos del aparato locomotor y algunos tipos de cánceres) crece con el IMC1.
Ante esta situación, la OMS ha creado el Plan de Acción Mundial para la Prevención y el Control de las Enfermedades No Transmisibles con el que pretende que en 2025 se alcance una reducción relativa del 25% en la mortalidad prematura por estas enfermedades, para lo que es fundamental detener el aumento de la obesidad a nivel mundial y volver a las tasas de 20101.
La obesidad y el dolor: compañeros inseparables
La literatura muestra un sinfín de trabajos que relacionan la obesidad con el dolor. Entre ellos es famoso el resultado de una encuesta de Gallup realizada entre 2008 y 2010 entre más de un millón de estadounidenses. Cuando se les preguntó por el dolor, las personas con sobrepeso (IMC entre 25 y 29,9) mostraron una tasa de dolor un 20% superior a la de las personas sin sobrepeso. Alarmantemente, la tasa de dolor diario de las personas con obesidad clase III era un 254% mayor a la de las personas con IMC normal3. Por tanto, la obesidad parece incrementar el dolor, y a mayor IMC, mayor dolor3.
Otro trabajo muestra que, en las mujeres con artrosis, el IMC es un 24% superior al de las mujeres sin artrosis, y se ha comprobado que las articulaciones degeneran más rápidamente en las personas con sobrepeso. Los estudios relacionan la sobrecarga de las estructuras de la columna vertebral con el dolor lumbar en las personas obesas3,4. Además, se sabe que el estilo de vida sedentario y la actividad física insuficiente se asocian con el incremento de la incidencia del dolor lumbar y que son factores de riesgo independientes para el desarrollo de la obesidad, confirmando la relación entre obesidad y dolor lumbar5. Un estudio reciente concluyó que el 80,6% de la población obesa presentaba dolor lumbar, frente al 60% de las personas con IMC normal5.
Además, se ha demostrado que la obesidad es un factor de exacerbación de la migraña3 y una comorbilidad frecuente en la fibromialgia. Los estudios apuntan a que un 32-50% de los pacientes con fibromialgia presentan obesidad y el 21-28% sobrepeso3.
El sobrepeso y la obesidad también se relacionan directamente con el desarrollo de artrosis, la causa más frecuente de artralgia y de discapacidad, y que se caracteriza por la estenosis del espacio articular y la esclerosis subcondral3. En los pacientes con sobrepeso se ha observado un aumento del riesgo de artrosis de rodilla 2,2 veces superior al de las personas con peso normal. En el Reino Unido, el 69% de las prótesis de rodilla se implantan en mujeres de mediana edad debido a la obesidad3.
¿IMC, obesidad central o grasa corporal?
Las afecciones musculoesqueléticas ocupan el segundo lugar mundial tras las afecciones mentales en cuanto a años vividos con discapacidad. El dolor musculoesquelético puede llevar a evitar la actividad física y el aumento de peso, que puede conducir a la obesidad2. Hemos establecido la relación bidireccional que existe entre esta última y el dolor musculoesquelético, pero es necesario comprender mejor esta relación para establecer mejores tratamientos2.
Hoy día crece la evidencia de que el peso corporal no sería el mejor indicador del riesgo de dolor musculoesquelético, sino el contenido en grasa corporal. Existen estudios que demuestran que la obesidad está relacionada con el dolor causado por el impacto con el suelo, mientras que la masa muscular protegería frente a estos impactos, por lo que la relación entre estos dos tejidos es más importante que el peso en si2.
Además, el tejido adiposo es un activo órgano endocrino que, cuando está hipertrofiado, secreta gran cantidad de citoquinas proinflamatorias como el factor de necrosis tumoral (TNF), la interleucina-6 (IL-6) y la interleucina-1β (IL-1β) y hormonas que pueden generar un marco de inflamación crónica de bajo grado relacionado con el dolor musculoesquelético2,5. Además, los obesos tienen altas concentraciones de PCR, un marcador inflamatorio de fase aguda que produce el hígado en contacto con IL-65.
Todos estos argumentos hacen pensar a algunos autores que el IMC no tiene en cuenta la composición de los tejidos, ni su distribución. Tampoco considera las diferencias debidas a la edad o el sexo. Por eso proponen que el IMC sea sustituido por el Índice de Grasa Corporal (IGC) en cuanto a factor de riesgo para el dolor musculoesquelético2.
EL IGC es fácil de medir con técnicas como la absorciometría de rayos X de energía dual, el análisis de impedancia bioeléctrica y el espesor del pliegue cutáneo. Los estudios han demostrado que su nivel elevado se relaciona con un mayor riesgo de dolor articular, dolor lumbar, de pies y rodilla2.
Sin embargo, otros autores abogan por el uso de la circunferencia de cintura y la relación entre la circunferencia de la cintura y de la cadera. Se trata del índice de Obesidad Central (OC), que estima razonablemente bien la proporción de tejido adiposo visceral y subcutáneo6. Además, es muy sencillo de medir6.
No existen muchos estudios que relacionan la OC con la osteoartritis (OA), pero sí en su relación con el síndrome metabólico y la OA. La obesidad abdominal tiene una alta correlación con las enfermedades cardiovasculares (EC) y con la mortalidad coronaria. Por otra parte, se ha observado que el riesgo de EC en las personas con OA es un 24% superior al del resto de la población y es la mayor causa de mortalidad específica en este grupo6.
Algunos trabajos han demostrado el mayor valor predictivo de la OC frente al IMC como factor de riesgo de EC en mujeres con OA, concluyendo que podría influir en la aparición temprana de síntomas articulares además de ser un factor de riesgo de EC en mujeres con OA6.
Tratamiento del dolor en personas obesas
El tratamiento del dolor en personas con sobrepeso tiene dos vertientes: la conveniencia de pérdida de peso, y las particularidades de estos pacientes frente a los tratamientos analgésicos.
¿Cómo pueden reducirse el sobrepeso y la obesidad?
El sobrepeso y la obesidad, así como las enfermedades no transmisibles vinculadas, son prevenibles en su mayoría. Para su prevención son fundamentales unos entornos y comunidades favorables que permitan influir en las elecciones de las personas. El objetivo es que la opción más sencilla (la más accesible, disponible y asequible) sea la más saludable, en materia de alimentos y actividad física periódica1.
A su vez, es conveniente recomendar a los pacientes que limiten el consumo de grasa total y de azúcares, aumentado las frutas y verduras, legumbres, cereales integrales y frutos secos1. Además, es conveniente realizar una actividad física periódica (60 minutos diarios para los jóvenes y 150 minutos semanales para los adultos)1,4.
Pero la simple recomendación de la pérdida de peso no es suficiente, pues hay factores genéticos y metabólicos que contribuyen al cuadro clínico completo y que deben ser contemplados. Los pacientes obesos pueden haber tenido muchas experiencias negativas en sus vidas, incluyendo su relación con los médicos, que a menudo los contemplan como personas que han creado su propio problema3. Es fundamental dedicar el tiempo necesario a estos pacientes, y animarles a participar en la planificación de su tratamiento, ayudándoles, sobre todo, a establecer objetivos realistas y alcanzables3.
El tratamiento del dolor en las personas obesas
Como es habitual, con independencia del origen del dolor, es necesaria una estrategia multifactorial para conseguir el mejor resultado3. Hay que tener en cuenta que la eficacia de los analgésicos puede estar influida por el IGC. En los pacientes con mucho tejido adiposo, la unión de los analgésicos a las proteínas está reducida, lo que puede hacer necesario un cálculo personalizado de las dosis3. También hay que considerar la presencia de esteatosis hepática o la reducción de la función renal3.
Los pacientes obesos pueden tolerar los opiáceos, pero requieren un control más estrecho para evitar la sedación o la depresión respiratoria. En muchos de estos pacientes aparece la apnea del sueño, que es un factor de riesgo para la depresión respiratoria con el uso de opioides3.
Por supuesto, las opciones deben incluir, además de la medicación, otras formas de tratamiento, como la acupuntura, la anestesia regional o la medicina integrativa.
El ejercicio físico es un tratamiento no farmacológico importante para el dolor musculoesquelético en personas obesas5,7. Existen estudios con diversos regímenes de ejercicio. Entre ellos, el entrenamiento por intervalos de alta intensidad (entrenar repetidamente a una alta intensidad durante 30 seg. separados por intervalos de recuperación de 1 a 5 min.) ha llamado la atención de los médicos, debido a su efecto en la reducción de los depósitos de grasa y la mejoría de la capacidad aeróbica5. Además, los pacientes encontraban más satisfacción en este tipo de entrenamiento5.
Otros tipos de ejercicios recomendados para los pacientes obesos con dolor son el yoga y el pilates. El yoga es una práctica de cuerpo-mente que usa movimientos de peso corporal en suelo, técnicas de respiración, meditación y relajación, promoviendo adaptaciones psicofisiológicas asociadas con la mejora de los parámetros antropométricos, la composición corporal y la condición física7. Similares beneficios se obtienen con el pilates, y ambos se consideran ejercicios eficientes, seguros y atractivos7.
La obesidad es un gran problema a nivel mundial. Se trata de una enfermedad no transmisible altamente relacionada con las enfermedades cardiovasculares, la diabetes, algunos tipos de cáncer y afecciones musculoesqueléticas. Cuando concurren obesidad y dolor, el médico se halla frente a un reto en el que no debe olvidar la obesidad como factor contribuyente al dolor y considerar las particularidades que la obesidad confiere al paciente.



ARTÍCULO
LOS CUIDADOS PALIATIVOS EN ATENCIÓN PRIMARIA
Lamentablemente, tenemos que asumir que la muerte es un resultado de salud universal1. Además, hoy en día gracias a los avances científicos y técnicos2, sólo una pequeña proporción de las muertes son repentinas, y la mayoría de las personas mueren a una edad avanzada, tras una trayectoria predecible y después de un periodo prolongado de discapacidad, fragilidad y enfermedad. La muerte se produce “en un momento impredecible debido a una enfermedad crónica predeciblemente fatal”1.
La mayoría de las personas en el mundo occidental dicen que preferirían recibir atención en el final de la vida y morir en casa1,3. Sin embargo, frecuentemente estos deseos no se cumplen y la muerte en casa se ha propuesto como una medida de la calidad de las atenciones del final de la vida1,3.
Esta discrepancia entre los deseos de los pacientes y la realidad, evidencian un importante reto para los sistemas sanitarios en el que los médicos de Atención Primaria (AP) tienen una posición óptima para actuar1. Aunque los profesionales de AP pueden sentir que los cuidados paliativos (CCPP) requieren mucho tiempo, con un manejo sistematizado, pueden llegar a ser satisfactorios y eficientes1.
La definición más reciente de cuidados paliativos fue publicada en 2018 y elaborada tras un amplio proyecto en el que participaron más de 400 miembros de 88 países de la International Association for Hospice & Palliative Care (IAHPC)4. Los CCPP se definen como “una intervención holística activa, ofrecida a personas de todas las edades que se encuentran en un intenso sufrimiento relacionado con su salud, como resultado de una enfermedad grave, especialmente aquellas al final de la vida”4. Su objetivo es, por tanto, mejorar la calidad de vida de los pacientes, sus familias y sus cuidadores2–4.
Algunos estudios apuntan que los cuidados paliativos podrían ser demandados por 20 millones de personas al año a nivel mundial, de las cuales el 69% serán adultos de más de 60 años y el 6% podrían ser niños2. Se espera que el 87% de los pacientes necesitarán cuidados paliativos en 20602. Por esto, es urgente la incorporación de estos instrumentos en la práctica clínica5.
Los tres procesos clínicos claves en los CCPP domiciliarios
Los médicos de AP juegan un papel de centinela en el manejo de los CCPP de sus pacientes. Sin embargo, los conceptos erróneos sobre qué enfermos necesitan recibir estos cuidados pueden ser un obstáculo para satisfacer las necesidades de los pacientes2. En general, basta con observar tres procesos clínicos clave de los CCPP1.
El riesgo de deterioro y muerte
La herramienta clínica más sencilla para identificar este riesgo es la pregunta sorpresa: “¿Le sorprendería que el paciente muriera en los próximos 12 meses?"1. Aunque útil, la respuesta a esta pregunta puede ser algo subjetiva. Afortunadamente existen otros medios más estructurados para identificar a los pacientes con indicadores de salud deteriorada y signos clínicos que indican una vida limitada. Se trata del SPICT (Supportive and Palliative Care Indicator Tool), que ha ganado aceptación a nivel internacional.

Figura 1. Herramienta con indicadores de cuidados paliativos y de apoyo (SPICT). Reproducido con permiso del programa internacional SPICT
El uso sistemático de SPICT, junto con la pregunta sorpresa, estimula a los médicos a organizar un tratamiento de soporte integrado con el tratamiento de las afecciones subyacentes del paciente1. La identificación de las personas en riesgo permite iniciar la planificación de los tratamientos paliativos más adecuados, adaptados a los deseos del paciente y con la colaboración de su entorno1.
Según un estudio que analizó las preferencias sobre los cuidados paliativos domiciliarios de 15 pacientes con cáncer en estadio terminal, los pacientes expresaron su deseo de morir en casa de una manera estable, a pesar de la evolución de su enfermedad3. Este trabajo también concluyó que los pacientes desean “mantenerse en el presente” a lo largo de todo el proceso3. Otro deseo es “sentirse seguros y a cargo de sus propias vidas”, sobre todo cuando siente que su capacidad va declinando3.
Por último, los pacientes también expresan la necesidad de “ser vistos y reconocidos” y que el personal sanitario mantenga un diálogo abierto que los reconozca como personas autónomas involucradas en las decisiones sobre su bienestar3.
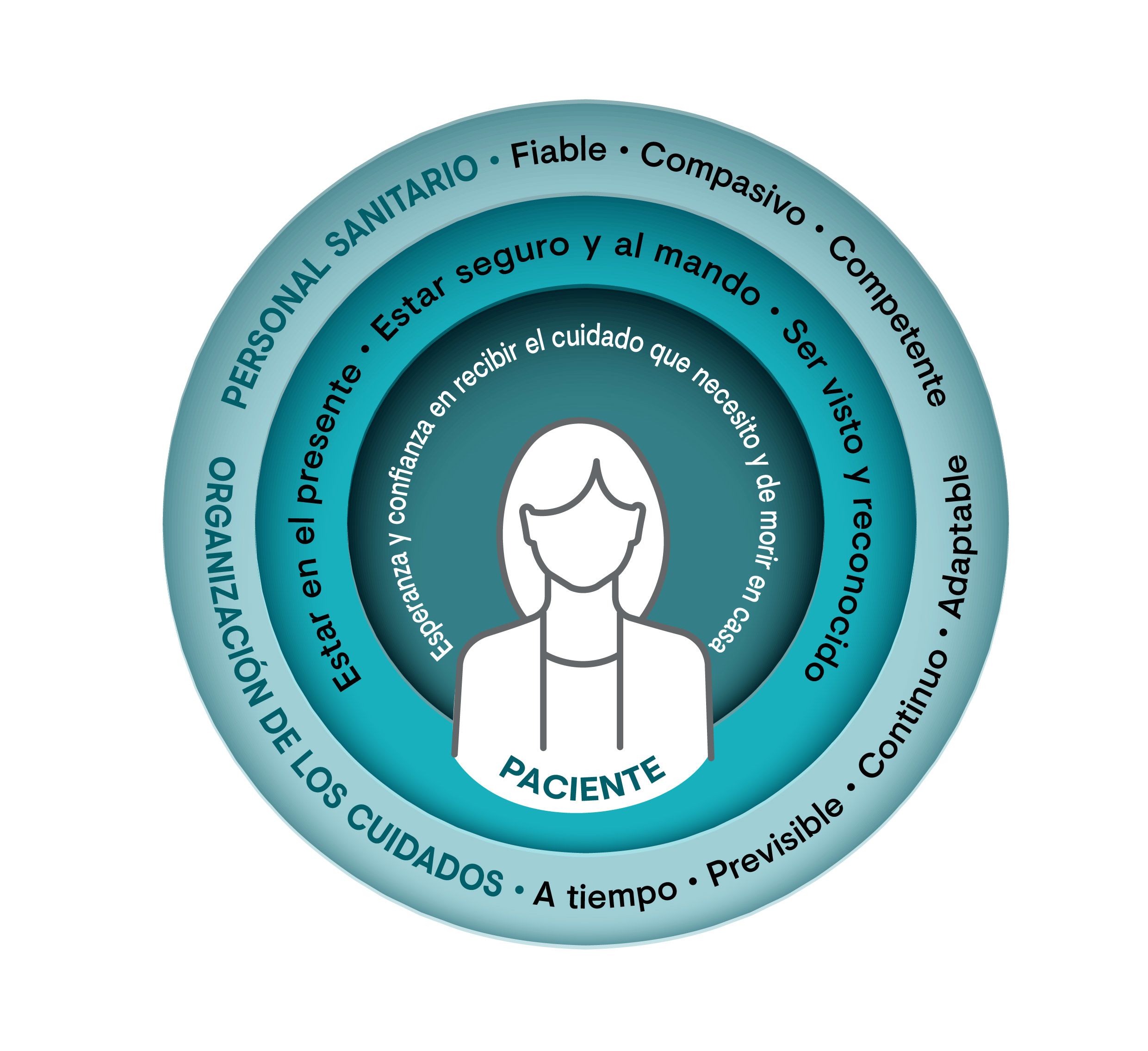
Figura 2. Modelo conceptual de las preferencias por la atención domiciliaria a lo largo del tiempo en pacientes adultos con cáncer en fase paliativa tardía para posibilitar la muerte domiciliaria. Figura adaptada de Nysæter TM, et al. 2022.3
Objetivos médicos del plan de cuidados del paciente
Una vez que se conocen los deseos de paciente, éstos deben convertirse en instrucciones médicas precisas que los respeten. Ya sean aumentos de nivel de tratamiento, limitaciones de tratamientos activos, cesación de prescripción y soporte o traslados al hospital1. Además, el plan debe ser conocido por el paciente (si es posible), su sustituto en la toma de decisiones y otros cuidadores, lo que ha demostrado disminuir la incertidumbre y la angustia1.
Desarrollo de un plan de cuidados terminales
Cuando el pronóstico del paciente se limita a semanas o incluso días, el objetivo es una evaluación regular de la comodidad del paciente y el alivio de la angustia del cuidador y de la familia1. Los cuidadores deben ser entrenados en el control de los síntomas súbitos para evitar el sufrimiento1.
El equipo de Cuidados Paliativos
Los CCPP implican diferentes perspectivas y dimensiones, basados en equipos que se coordinan en el ámbito de la Atención Primaria1. La mayoría de los equipos de cuidados paliativos en el hogar están dirigidos y coordinados de manera proactiva por el médico de Atención Primaria. Los miembros del equipo varían y deben determinarse según las necesidades del paciente y la disponibilidad local de profesionales. Incluyen médicos, enfermeras, trabajadores sociales, terapeutas ocupacionales, otros profesionales de la salud y el farmacéutico local1.
Todos ellos deben ser fiables, competentes, y sobre todo compasivos1,3, en el sentido de empatizar con el paciente y tener como objetivo reducir su sufrimiento, para ayudar a la persona a lograr una buena muerte1. Esto incluye proporcionarle comodidad, apoyo psicológico y sensación de seguridad, aliviando el temor al proceso de morir1,3.
Un aspecto clave es la puntualidad o la rutina, así como la continuidad de los profesionales, lo que aporta a los pacientes predictibilidad y seguridad en su vida cotidiana. Las situaciones impredecibles causan estrés en los pacientes, sentimientos de pérdida de energía, ansiedad e irritación3.
También hay que comprender que algunos médicos de cabecera pueden estar desbordados y con grandes dificultades para ofrecer CCPP a sus pacientes, en estos casos, lo conveniente es organizar una alternativa razonable que cumpla los deseos del paciente y los objetivos clínicos1.
Los cuidados paliativos en España
En nuestro país, los CCPP forman parte de las transferencias de salud que asumieron las CCAA6. Iniciaron su implantación y desarrollo en los años ochenta y noventa del siglo pasado como resultado de iniciativas personales, muchas veces con el apoyo de instituciones como la Asociación Española contra el Cáncer y la Orden Hospitalaria de San Juan de Dios6.
A finales de los años noventa, el Ministerio de Sanidad y Consumo se planteó actualizar las estructuras y la planificación sanitaria para integrar la atención paliativa en los Servicios de Salud, y en 2001 se publicaron las Bases para el Desarrollo de un Plan Nacional de Cuidados Paliativos, con un modelo de atención integral e interdisciplinar que permitiera responder a las necesidades reales de la población6.
Con la descentralización de la sanidad, cada comunidad autónoma comenzó a desarrollar planes para la implantación de los CCPP en cada una de ellas6. Sin embargo, en un trabajo publicado en España en 20196, se aprecia que tras el trabajo realizado para promover estos programas, no se observa el mismo interés por renovarlos, actualizarlos y mantenerlos vigentes6. Según indica este informe, la actualización continua de estos planes los convertiría en una ayuda real para mejorar la calidad y la extensión de los cuidados y de la atención paliativa en las CCAA6.
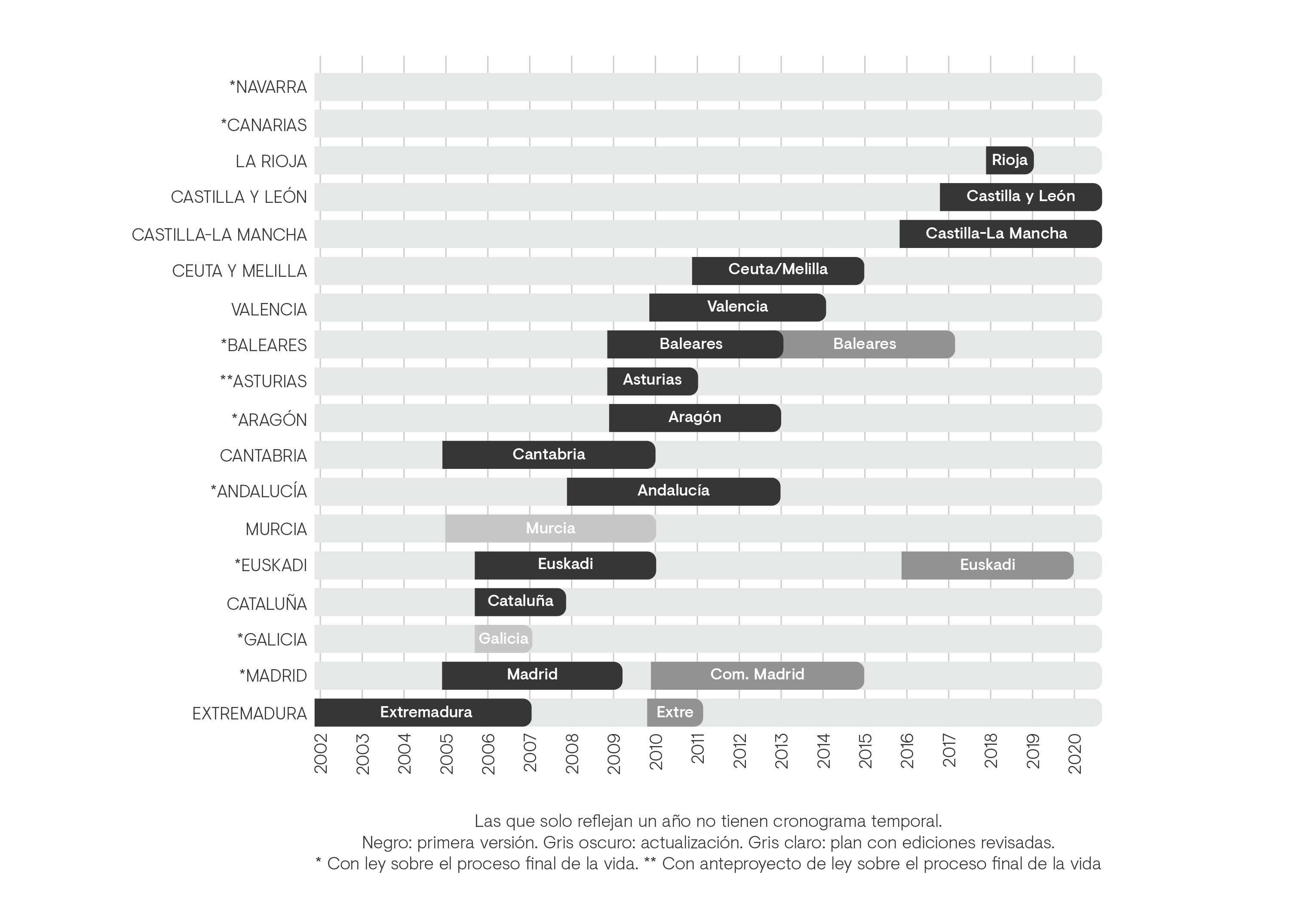
Figura 3. Planes estratégicos de las comunidades autónomas. Figura adaptada de Sánchez Gutiérrez ME, et al. 2019.6
Imprescindibles en el futuro
El envejecimiento de la población y el deseo creciente de los pacientes de morir en casa, en un ambiente familiar y seguro, nos dirigen a un aumento importante de la necesidad de CCPP en el futuro. Los pacientes y sus familiares demandarán cuidados cada vez más completos para mejorar su calidad de vida2.
Los pacientes desean mantener una vida con significado hasta el momento de su muerte, con autonomía y reconocimiento. Será necesario un equipo de cuidadores competentes, organizados y compasivos, a la vez que equipos estables y rutinas de cuidados. La muerte en el hogar requerirá de un enfoque centrado en la persona, con reevaluación continua del plan de cuidados y el uso de herramientas avanzadas3.
La evidencia muestra que los equipos de AP, por su proximidad al paciente y su familia, son más que adecuados para colaborar en los CCPP del paciente, aunque aún es necesario profundizar y organizar adecuadamente los CCPP domiciliarios4.





MÁS ALLÁ DEL DOLOR
EL DOLOR EN LAS ENFERMEDADES RARAS
El problema de salud más frecuente
Según la Encuesta Europea de Salud en España de 2020 (EESE 2020), el dolor físico de cualquier intensidad afecta al 40,26% de la población mayor de 15 años1, y es uno de los motivos de consulta más frecuentes en Atención Primaria2. Las mujeres son las más afectadas con un 47,54%, frente a un 32,54% de los hombres1. Además, la prevalencia de dolor aumenta con la edad, y encontramos que el 56,69% de la población mayor de 65 años lo padece, siendo el 70,91% en los mayores de 85 años1. En cuanto a su intensidad, el 11,68% de los mayores de 65 años refieren dolor de intensidad extrema1.
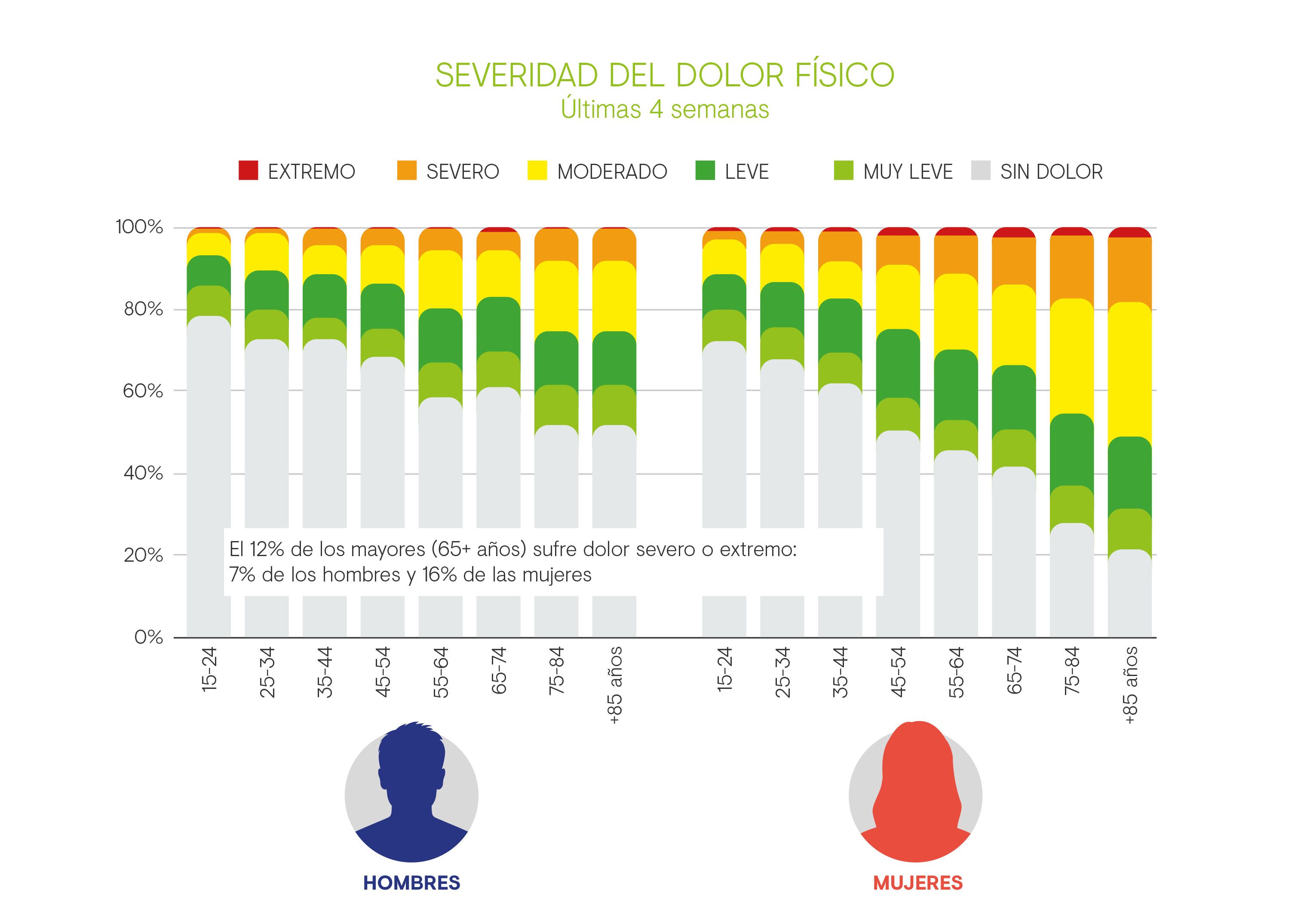
Figura 1. Figura adaptada de Instituto Nacional de Estadística. Encuesta Europea de Salud en España (EESE 2020). Accessed February 2, 2023. https://www.sanidad.gob.es/estadEstudios/estadisticas/EncuestaEuropea/EncuestaEuropea2020/EESE2020_inf_evol_princip_result.pdf1
Además, el dolor puede a su vez clasificarse en función de su fisiopatología. Si el dolor persiste más de 3-6 meses, se trata de un dolor crónico, y este puede ser benigno o maligno (todos los dolores secundarios a un proceso oncológico o sus tratamientos)3.
Todos estos tipos de dolor pueden a su vez clasificarse en función de su fisiopatología. El transmitido por el sistema somatosensorial será nociceptivo si tiene su origen en un tejido corporal: visceral si procede de órganos internos y somático si es del resto de tejidos del cuerpo. Si el sistema somatosensorial se altera por una lesión o enfermedad evidenciable se trata de un dolor neuropático. Por último, el dolor psicógeno es el que no puede atribuirse a una causa orgánica3.
Los médicos de Atención Primaria saben que el 37% de las personas que consultan por dolor son pacientes oncológicos (hasta un 67,6% de los pacientes con enfermedad avanzada padecen dolor). También, que en la mayoría de sus pacientes (71% en algunos estudios) el dolor es de origen musculoesquelético2. No en vano, las enfermedades reumáticas son la primera causa de incapacidad y el 20% de la población adulta las padece, sobre todo vinculadas a patologías degenerativas como la osteoporosis o la artrosis3.
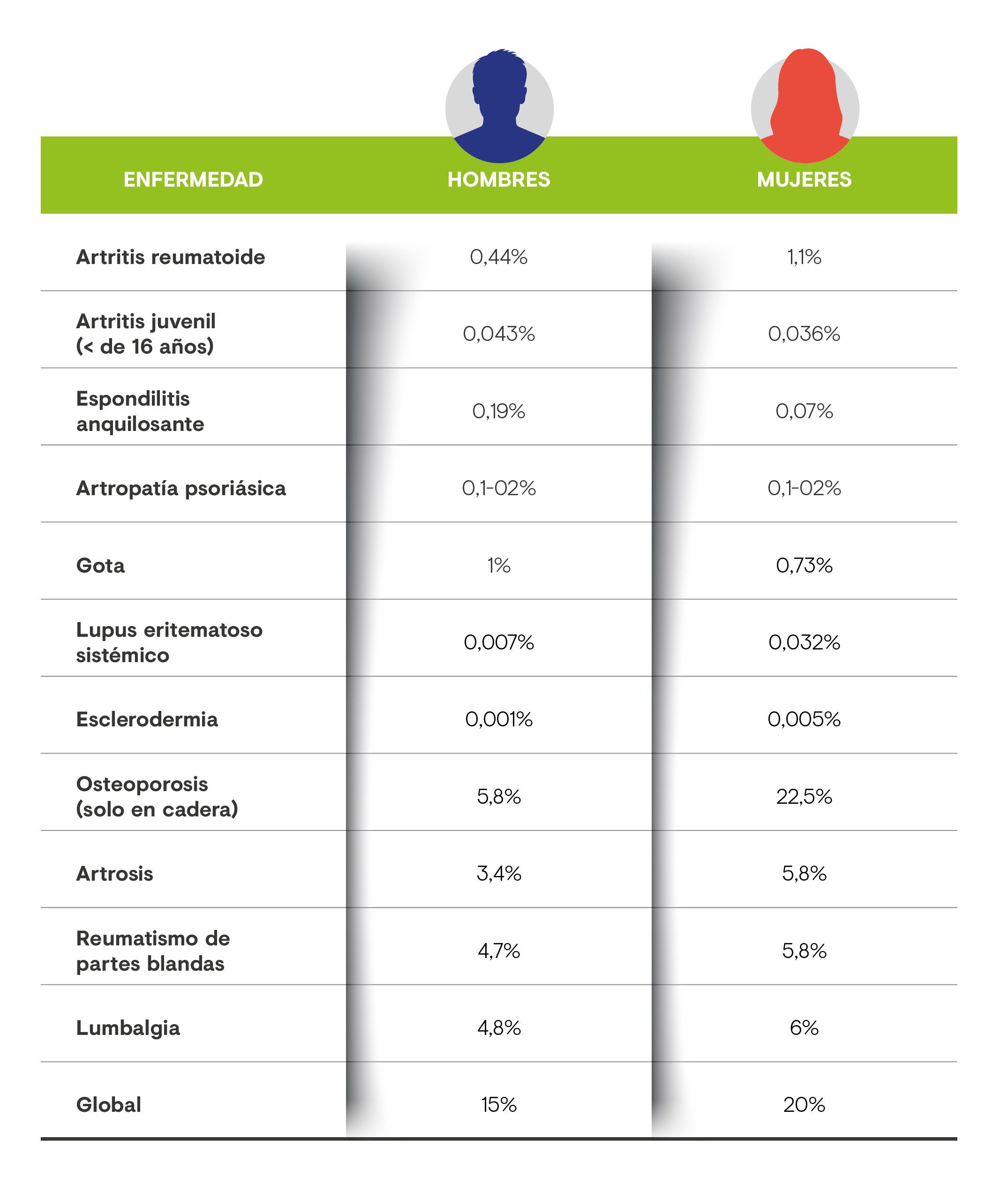
Tabla 1. Prevalencia de distintas enfermedades reumáticas en la población general.3
Sin embargo, en ocasiones aparecen pacientes que no se incluyen en los patrones normales, cuyo dolor presenta aspectos que no encajan en la práctica habitual. Son dolores de origen diferente, con una cohorte de síntomas que pueden desconcertar al clínico. En estos casos, podemos estar ante una de las muchas enfermedades raras que cursan con dolor.
Los quistes de Tarlov
Uno de estos casos podría responder a los quistes de Tarlov (QT). También son conocidos como quistes perineurales o de la raíz nerviosa del sacro. Se trata de dilataciones de las vainas de la raíz nerviosa, que forman sacos llenos de líquido cefalorraquídeo (LCR) y que pueden causar una radiculopatía progresivamente dolorosa4,5. Pueden formarse en cualquier sección de la columna vertebral y hasta en un 11% de los pacientes aparecen en más de una ubicación de la columna4.
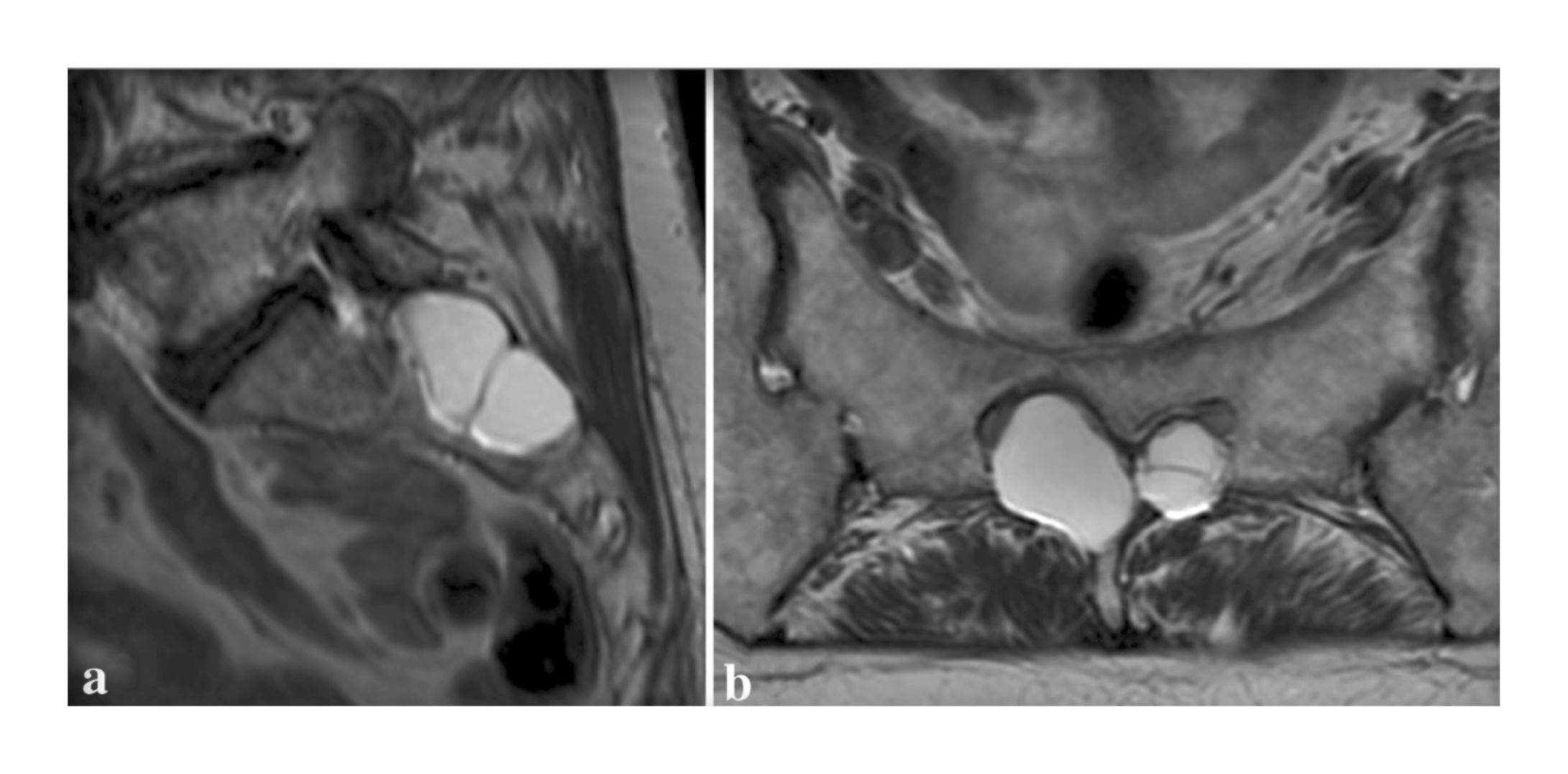
Figura 2. (a) Exploraciones sagitales y (b) axiales de resonancia magnética que muestran múltiples quistes de Tarlov en el nivel sacro S2 que causan erosión ósea.
Aunque la literatura muestra un amplio rango de incidencias, un meta-análisis realizado con 13.266 pacientes de 22 estudios muestra una prevalencia global agrupada del 4,27%5. En este trabajo también se muestra que sólo alrededor del 15,59% manifiesta síntomas5.
Se piensa que los QT son un hallazgo radiológico común, frecuentemente asintomático, de forma que en ausencia de síntomas, o incluso mínimamente sintomático, puede quedar sin informar por el radiólogo, o no ser considerado por el médico que pidió la prueba4,5. Si el quiste ha estado presente durante años puede aparecer erosión y remodelación del hueso sacro u otras vértebras de la columna4. En determinadas condiciones, los quistes se llenan con más LCR comprimiendo importantes fibras nerviosas lo que origina una variedad de síntomas que incluyen el dolor crónico4.
La causa de la formación de los quistes es desconocida, pero sí se conocen algunos mecanismos que pueden provocar un aumento de la presión del LCR, aumentando su flujo a los quistes y aumentando su volumen, provocando la sintomatología. Entre aquellos estarían las lesiones traumáticas (caídas, accidentes de coche…), levantar objetos pesados, el parto y las anestesias epidurales4. También se ha observado su empeoramiento durante los brotes de herpes simple, sin que este, ni ningún otro virus sea la causa de los QT4. Además, se ha evidenciado que las mutaciones de colágeno o los trastornos del tejido conectivo (Marfan, Ehlers-Danlos, Sjorgen…) predisponen al desarrollo de los quistes4.
En cuanto a la sintomatología, es muy variada, lo que dificulta su identificación. Incluye dolor en la parte baja de la espalda, especialmente en nalgas, piernas y pies; dolor en pecho, parte superior de la espalda, cuello, brazos y manos; debilidad o calambres en piernas, pies, brazos y manos; parestesias según la localización de los quistes; dolor sentado o de pie; dolor al estornudar o toser; incapacidad para vaciar la vejiga o retención de orina; cambios en los hábitos intestinales; inflamación del área sacra; dolor, presión y sensibilidad en función de la localización del quiste; dolores de cabeza, a veces acompañado de visión borrosa, doble o presión tras los ojos; ciática; dolor vaginal, pélvico y/abdominal; síndrome de piernas inquietas; disfunción sexual…4,5
El diagnóstico se realiza con RMN, TAC o mielograma y la aspiración del LCR de los quistes, si alivia los síntomas, puede confirmarlo. Sin embargo, aunque la aspiración del LCR alivie el dolor del paciente, los quistes vuelven a llenarse de LCR por lo que no es una solución definitiva4. Se ha intentado sellar los quistes con pegamento de fibrina, evitando que vuelvan a llenarse de LCR. Aunque se consiguen alivios a largo plazo, sigue considerándose una solución temporal4.
Otros tratamientos que se han intentado son el TENS (estimulación nerviosa eléctrica transcutánea) que ha mostrado su utilidad en algunos casos. En cuanto al ejercicio, con frecuencia es contraproducente, mientras que otros tipos de fisioterapia como el calor o los ultrasonidos han dado mejores resultados4.
El pronóstico de los QT es variado, desde pacientes que sufren incapacidad, hasta los que mejoran notablemente. Para mejorar este pronóstico, es necesaria la formación de los profesionales de la salud, tanto en su identificación como en su manejo4.
Südeck: síndrome de dolor regional complejo
El Síndrome de Dolor Regional Complejo (SDRC) es una condición crónica caracterizada por hiperalgesia y alodinia que afecta principalmente a las extremidades y frecuentemente se desarrolla tras un trauma o una cirugía en las mismas6. Su definición y diagnóstico ha evolucionado a lo largo de la historia, y ha sido denominado “distrofia simpática refleja”, “causalgia”, “algoneurodistrofia” o “atrofia de Südeck”6.
Actualmente se consideran dos tipos de SDRC: el tipo I aparece en pacientes sin un daño nervioso confirmado, mientras que en el tipo II se identifica un daño nervioso claro. Sin embargo, el diagnóstico se basa con frecuencia en los hallazgos clínicos, ya que no hay pruebas específicas6.
La presentación clínica y la progresión del SDRC es variable y algunos pacientes sufren un grave deterioro de su calidad de vida, con un mal pronóstico a pesar del tratamiento. Por eso el diagnóstico e inicio de tratamiento precoces son fundamentales para limitar la progresión y mejorar la calidad de vida6.
En un estudio realizado en EEUU publicado en 2016 con datos recogidos entre 2007 y 2011 sobre 33 millones de pacientes dados de alta del hospital, el 0,07% recibieron un diagnóstico de SDRC. En un trabajo posterior con 6,5 millones de pacientes de la base de datos de la Truven Market Scan Commercial and Medicare Supplemental, se estableció una prevalencia del 1,2%6.
Entre los factores de riesgo desencadenantes más frecuentes nos encontramos con las lesiones de las extremidades, como fracturas, los esguinces o la cirugía. El orden según su frecuencia sería: fracturas (42%), otras lesiones traumáticas severas excluyendo las fracturas (21%), la cirugía (12%), el síndrome del túnel carpiano (7%) y el 7% no tendrían un desencadenante claro6. Aunque su influencia en la prevalencia del SDRC es relativamente pequeña6.
Otros factores de riesgo identificados son el sexo femenino, raza caucásica, ingresos domésticos medio-altos, y la presencia de comorbilidades como depresión, abuso de drogas o cefalea6. Sin embargo, la obesidad, diabetes, hipotiroidismo y anemia, se asocian a tasas más bajas de SDRC6. La fibromialgia está asociada a un riesgo 2,5 veces superior de padecer SDRC6.
La patofisiología no es muy conocida, pero hoy en día se admite que el SDRC se debe a una respuesta anormal del tejido al trauma, además de una sensibilización del sistema nervioso central y periférico, acompañado de cambios inflamatorios y desregulación autonómica.
El curso clínico se desarrolla en dos fases. En la fase aguda o caliente, se liberan moduladores pro-inflamatorios (IL-6, IL-1β y TNF-α), mientras que en la crónica o fría se activan los queratinocitos, fibroblastos y osteocitos6.
El diagnóstico se realiza siguiendo los llamados criterios de Budapest (2003), que exigen la presencia de dolor desproporcionado al evento desencadenante y al menos un síntoma vasomotor, sudomotor/edema o trófico en el momento de la evaluación. Otro criterio es que no haya otra causa diagnóstica que explique mejor la clínica6.
El tratamiento precisa un enfoque multidisciplinar en el que intervienen especialistas en educación del paciente, fisioterapia y terapia ocupacional, psiquiatría y medicina del dolor, junto con intervenciones farmacológicas y quirúrgicas. Las terapias física y ocupacional son componentes iniciales clave para ayudar a los pacientes a superar su miedo al dolor y su cinesofobia6.
En cuanto a la medicación, se usan tratamientos sintomáticos con el objetivo de facilitar que el paciente participe en la rehabilitación. Entre ellos se encuentran los corticoides y los AINE, aunque estos tienen poca evidencia. Los bifosfonatos han mostrado efectos positivos, sin embargo, el mecanismo es desconocido. La gabapentina ha demostrado también buenos resultados, aunque la evidencia es corta. Otros tratamientos usados son la ketamina y los antioxidantes (básicamente vitamina C).
También se indican algunas técnicas quirúrgicas mínimamente invasivas como el bloqueo simpático o estimulación magnética transcraneal. Se está investigando el uso futuro de micofenolato como inmunosupresor, ya que hay una evidencia anecdótica que indicaría que mejora el dolor neuropático6.
Púrpura de Schönlein-Henoch
La púrpura de Schönlein-Henoch se denomina hoy vasculitis por inmunoglobulina A (IgA), y se define como una vasculitis leucocitoclástica (de vasos pequeños con infiltrado predominante de neutrófilos), mediada por complejos inmunes. Se caracteriza por una púrpura palpable no trombocitopénica, dolor abdominal y artritis7. Suele ser autolimitada, pero un subgrupo de pacientes experimenta un curso remitente-recidivante. Las complicaciones más frecuentes son la glomerulonefritis y las hemorragias gastrointestinales7.
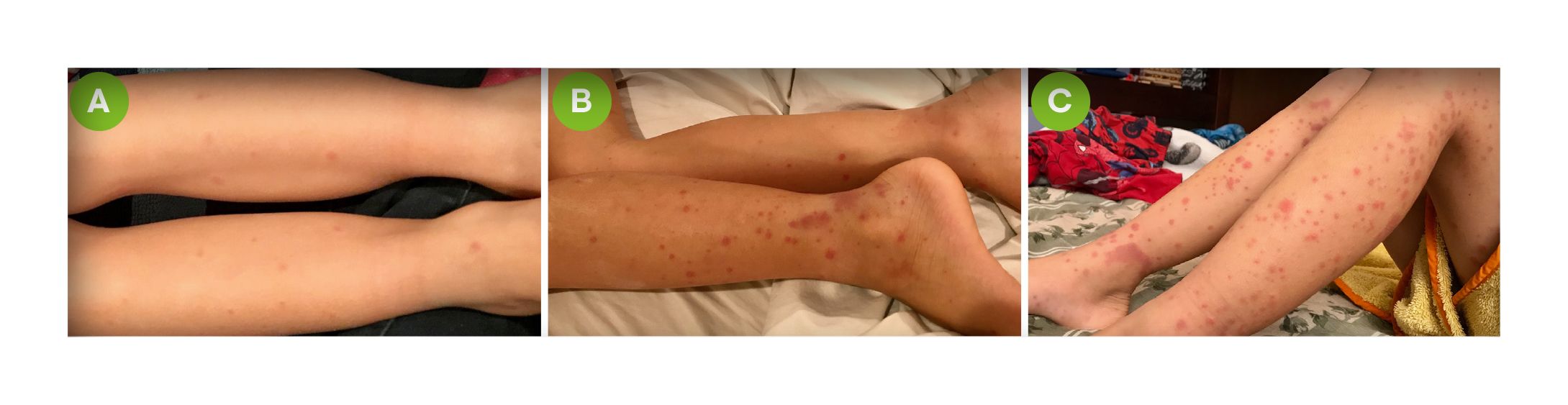
Figura 3. Progresión de la erupción en la vasculitis de inmunoglobulina a. (A) Etapa temprana. (B) Aparecen pápulas eritematosas, petequias y púrpura durante días o semanas. (C) Petequias y púrpura en diferentes etapas de desarrollo; obsérvese el aspecto de color herrumbre de las lesiones más antiguas. Figura adaptada de Reamy BV, et al. 2020.7
Es la vasculitis más frecuente en niños, en los que aparece en 3-26,7 de cada 100.000. En los adultos la incidencia es de 0,8-1.8 cada 100.000. En los menores de 2 años, la afección suele ser leve y más común en otoño e invierno, sin embargo, en los adultos es más grave, con peores resultados y sin patrón estacional7.
Se debe a depósitos inmunes de IgA en el sistema gastrointestinal, articulaciones, la piel y los riñones7. Se cree que varias infecciones bacterianas pueden desencadenarla, como el streptococcus, parainfluenza y el parvovirus humano. También se piensa que algunas citoquinas y quimioquinas podrían estar implicadas en su desarrollo. Incluso varios trabajos la relacionan con mutaciones en alelos de HLA. Sin embargo, la patofisiología aún no se ha establecido completamente7.
Se debe sospechar el diagnóstico de vasculitis de IgA en presencia de púrpura palpable junto con artralgia (75% de los pacientes) y dolor abdominal (50-65%)7.
El diagnóstico diferencial debe descartar la púrpura trombocitopénica inmune, abuso infantil, alteraciones de la coagulación, reacciones medicamentosas, púrpura senil, sepsis meningocócica, fiebre mediterránea familiar, fiebre de las Montañas Rocosas, leucemia aguda, síndromes de insuficiencia de médula ósea y otras vasculitis7.
La Liga Europea contra el Reumatismo junto con la Sociedad Europea de Reumatología pediátrica publicaron unos criterios diagnósticos con un 100% de sensibilidad y un 87% de especificidad en niños y 99% y 86% en adultos7.

Tabla 2. Adaptada de Reamy BV, et al. 2020.7
La sintomatología incluye la vasculitis que típicamente sigue a una infección respiratoria. Mientras que los niños presentan más artralgia y dolor abdominal, los adultos cursan con edema en las extremidades inferiores e hipertensión7. La artralgia es más frecuente en rodillas y tobillos que en articulaciones pequeñas y la artritis es temporal y no daña las articulaciones7.
La púrpura comienza como pápulas eritematosas que evolucionan a petequias y púrpura palpable y que puede extenderse, sobre todo en superficies extensoras y sujetas a presión7. El dolor abdominal es tipo cólico y puede ser severo. La enfermedad renal aparece en el 50% de los casos. También puede aparecer una leve fiebre7.
El tratamiento de soporte debe ser la primera opción, ya que la vasculitis por IgA se resuelve espontáneamente en el 94% de los niños y el 89% de los adultos. Las manifestaciones cutáneas no requieren tratamiento, y el dolor articular puede controlarse con paracetamol o AINE, aunque estos últimos están contraindicados en presencia de afectación renal, en cuyo caso habría que acudir al nefrólogo7.
La artralgia y el dolor abdominal pueden resolverse antes en los niños con el uso de prednisona, aunque sólo debe usarse en casos de dolor severo, ya que en cualquier caso se resolverán espontáneamente7.
Algunos factores pueden predecir la necesidad de hospitalización: orquitis, dolor abdominal moderado o severo, artritis en dos o más articulaciones, proteinuria, sangrado gastrointestinal e incapacidad para andar7.
La gravedad de la vasculitis por IgA radica en la afectación renal. Cualquier enfermedad renal basal previa a la nefritis IgA aumenta el riesgo de progresión a enfermedad renal terminal; sin embargo, se sabe menos sobre los factores predictivos de la progresión renal en adultos. Los adultos tienen un riesgo del 11% de padecer enfermedad renal terminal y del 13% de sufrir insuficiencia renal grave.
A veces, el médico de Atención Primaria se desconcierta ante unas manifestaciones dolorosas que difieren de lo que es habitual. Aunque son poco frecuentes, puede encontrarse ante los quistes de Tarlov, el Síndrome de Dolor Regional Complejo o la Púrpura de Schonlein-Henoch, o cualquier otra de las muchas enfermedades raras que cursan con dolor.


CONGRESOS Y JORNADAS
Consulta todos los congresos, jornadas, eventos y reuniones especializados en dolor.










