ÚLTIMA HORA
EN DOLOR
NOTICIAS


ARTÍCULO
LA NEUROPATÍA DIABÉTICA DOLOROSA
La diabetes es la mayor epidemia global del siglo XXI1,2. Se estima que 537 millones de personas en el mundo la padecen2. Sin embargo, si incluimos las personas con prediabetes, los números son aún más alarmantes. En 2019 se estimaba que 388 millones de personas en China, 133 millones en India y 85 millones en EEUU, padecían diabetes o prediabetes1, causando el 12% de los gastos en salud a nivel mundial1. En España, el 13% de la población adulta padece diabetes mellitus (DM)3.
Debido a sus complicaciones, la DM es la principal causa de ceguera en edad laboral, amputación no traumática de miembros inferiores y enfermedad renal crónica que precisa terapia renal sustitutiva (tratamientos de soporte vital para la insuficiencia renal)4.
También pueden aparecer un variado número de neuropatías autonómicas secundarias a la DM: neuropatía autonómica cardíaca, dismotilidad intestinal, neuropatía gastrointestinal, cistopatía e impotencia1.
La neuropatía diabética (ND), un grupo de síndromes clínicos causados por daños en el sistema nervioso periférico y autónomo, es, de lejos, la complicación más prevalente1. La ND afecta hasta a la mitad de los enfermos con DM1–3. Es un trastorno degenerativo del sistema nervioso periférico que afecta preferentemente a los axones sensoriales, autonómicos y posteriormente y en menor medida a los motores1.
Su manifestación más frecuente es la polineuropatía simétrica distal, que se caracteriza por una distribución en “guante y calcetín” (parte distal de las extremidades)1,3. Se manifiesta mediante síntomas sensoriales, como hormigueo, hiperestesia, quemazón o dolor, pero también motores, como espasmos, fasciculaciones y calambres3. Uno de cada 3 pacientes con DM termina desarrollando una forma severa de ND, la neuropatía diabética dolorosa (NDD)3.
Las investigaciones más recientes han demostrado que la ND se debe a algo más que la hiperglucemia sostenida; la explicación podría estar en el síndrome metabólico
Aunque la patogenia de la ND no ha sido claramente establecida, se sospecha que la hiperglucemia sostenida en el tiempo, sería la causante del daño a los nervios periféricos2,3.
El sistema nervioso periférico incluye neuronas pequeñas desmielinizadas o fibras pequeñas, que transportan la información nociceptiva asociada al dolor y el calor2. También hay fibras grandes mielinizadas que transportan la información táctil, de presión, frío, vibración y propiocepción2. Ambos tipos de fibras utilizan la glucosa y los lípidos para producir la energía necesaria para el impulso nervioso2.
Las investigaciones más recientes han demostrado que la ND se debe a algo más que la hiperglucemia sostenida. La explicación podría estar en el síndrome metabólico, que incluye hiperglucemia, dislipemia y obesidad. En las personas con DM, la hiperglucemia y la dislipemia provocan que las mitocondrias (orgánulos celulares encargados de la producción de energía) se saturen, causando estrés oxidativo, inflamación y muerte de las neuronas con fallo axonal2. También pueden provocar la liberación de citoquinas y quimioquinas proinflamatorias que producen neurotoxicidad mediada por inflamación e inmunidad2.
Todos estos mecanismos producen inicialmente la degeneración y pérdida de las fibras pequeñas, causando disestesia, sobre todo en los pies, y dolor. Estaríamos ante la ND dolorosa o NDD2 que afecta a entre el 20% y el 50% de los pacientes con ND2,5. Los pacientes describen el dolor como quemazón, calambres, pinchazos, hiperalgesia (dolor exagerado ante un leve estímulo doloroso) y alodinia (dolor ante un estímulo que generalmente no causa dolor). Cuando la enfermedad progresa comenzaría la pérdida de las fibras grandes, con aparición de entumecimiento y pérdida de la propiocepción en los pies, que avanzaría a la parte superior de la pierna con el tiempo2. El avance de la NDD sería de distal a proximal por las extremidades2. Los síntomas suelen exacerbarse por la noche, lo que altera seriamente la calidad del sueño2.
Además, la pérdida de sensibilidad en las piernas pone a los pacientes de ND en un alto riesgo de heridas en piernas y pies, ulceraciones e infecciones, lo que aumenta la probabilidad de sufrir una amputación. Los que no presentan dolor están en mayor riesgo, debido a la ausencia del efecto de “aviso” que ofrece el dolor2. Por otra parte, la propiocepción alterada dobla el número de caídas y accidentes frente al de los pacientes con DM que no presentan ND2.
Conforme progresa, la neuropatía diabética disminuye la calidad de vida y la funcionalidad de los pacientes2. La historia natural de la neuropatía diabética dolorosa es variable y su curso clínico, impredecible. En algunos pacientes, el dolor puede mejorar después de meses o años, mientras que en otros persiste, empeora y se extiende. El mantenimiento de una hemoglobina glicosilada entre 6,5 y 7,5%, enlentece y puede incluso prevenir la progresión de la neuropatía4.
El diagnóstico temprano y el adecuado manejo de la neuropatía en el paciente con diabetes es importante porque hasta en el 50% de los pacientes la neuropatía diabética puede ser asintomática.
Diagnóstico por exclusión
El diagnóstico temprano y el adecuado manejo de la neuropatía en el paciente con diabetes es importante porque hasta en el 50% de los pacientes la neuropatía diabética puede ser asintomática, aumentando el riesgo de posibles lesiones en los pies2,4. La Asociación Americana de Diabetes (ADA), recomienda un cribado anual de la ND cuando los pacientes son diagnosticados de DM tipo 2 y a los 5 años en los pacientes de DM tipo 1 y anualmente desde entonces2.
Para identificar a los pacientes con ND el diagnóstico es fundamentalmente clínico. No son necesarios estudios electrofisiológicos cuando la historia clínica y los hallazgos físicos son consistentes con el diagnóstico4,5. Éste debe comenzar con una historia clínica completa que incluirá los antecedentes personales, hábitos tóxicos, especialmente de tabaquismo, años de evolución de la DM, grado de control glucémico alcanzado, presencia de otras complicaciones micro y macrovasculares, las características y factores desencadenantes del dolor4,5.
Es necesario establecer la intensidad y el tipo de dolor. Para lo primero se utiliza la escala visual analógica (EVA). Para confirmar que el dolor es o no de origen neuropático puede usarse la escala DN-4, de alta sensibilidad y especificidad en el diagnóstico del dolor neuropático. Consta de 10 ítems de respuesta sí o no (sensación de quemazón, alfileres, frio-doloroso, descarga eléctrica, hormigueo, entumecimiento, picazón, hipoestesia al tacto o los pinchazos y roce doloroso). Tres o más respuestas positivas confirman el dolor neuropático5.
El segundo paso sería realizar una exploración física (peso, talla, IMC, tensión arterial y frecuencia cardíaca)4. Además, hay que hacer una evaluación neurológica completa de las extremidades, valorando la sensibilidad algésica, táctil, vibratoria, térmica, a la presión y los reflejos osteotendinosos5. Esta evaluación se realiza con el monofilamento de 10g o de Semmes-Weinstein, un diapasón de 128 Hz y un martillo de reflejos5. La ADA recomienda realizar siempre el test del monofilamento acompañado al menos de la exploración de vibración, temperatura o sensibilidad térmica, ya que además de establecer la presencia de disfunciones en el sistema nervioso periférico, permiten predecir futuras complicaciones5.
El diagnóstico debe completarse con la realización de una analítica que incluya hemograma, bioquímica con glucemia, hemoglobina glicosilada, perfil lipídico, renal y tiroideo. También se puede evaluar la vitamina B12 y una serología luética, para descartar otras posibles causas de la neuropatía4.
Entre el 20% y el 50%2,5 de los pacientes con ND presentarán cuadros dolorosos
Aliviar el dolor
Entre el 20% y el 50%2,5 de los pacientes con ND presentarán cuadros dolorosos, pero éstos son de difícil control5. No se recomiendan los AINEs por el alto riesgo de nefrotoxicidad5.
En primera línea se recomienda el uso en monoterapia de un antidepresivo tricíclico, un antiepiléptico (bloqueador de los canales del calcio) o un inhibidor selectivo de la recaptación de noradrenalina y serotonina5. También se puede asociar un fármaco tópico de primera línea como la capsaicina en parches5.
En caso de intolerancia es necesario cambiar el grupo farmacológico. Si la tolerabilidad ha sido buena pero no se ha aliviado el dolor se pueden combinar fármacos de diferentes grupos5. Si no se alcanza el objetivo analgésico (que suele ser obtener una reducción del 50% de la intensidad del dolor)2, se pasaría a usar fármacos de segunda línea, comenzando por opioides débiles y pasando a opioides mayores, en caso necesario5.
El tratamiento farmacológico es útil para el manejo de los síntomas, principalmente el dolor. Sin embargo, también han mostrado cierto potencial en el manejo de esta patología las medidas no farmacológicas como el asesoramiento en dolor, el ejercicio y el uso de dispositivos de radiofrecuencia2.
Prevenir la ND
Los niveles de elevados de LDL, de triglicéridos, el IMC, la hipertensión y el tabaquismo son factores que también se asocian a una mayor incidencia de ND.
Una vez que el paciente presenta ND esta es irreversible, por tanto, es clave establecer medidas preventivas para evitar su desarrollo5.
La principal de ellas es el control estricto de la glucemia, que ha demostrado prevenir el desarrollo de ND en los pacientes con DM tipo 1, mientras que en los pacientes con DM tipo 2, la evidencia no es tan fuerte2,5. Estudios recientes han demostrado que los niveles de elevados de LDL, de triglicéridos, el IMC, la hipertensión y el tabaquismo son factores que también se asocian a una mayor incidencia de ND5. Algunos autores recuerdan que “no toda la neuropatía en diabéticos es de etiología diabética”, por lo que es conveniente evaluar otros factores de riesgo de neuropatía en estos pacientes2.
Una vez que el paciente ha desarrollado ND es fundamental evitar la aparición de lesiones y, por lo tanto, de las amputaciones asociadas. Hasta el 50% de las amputaciones de estos pacientes se pueden evitar mediante un diagnóstico precoz y un adecuado tratamiento5. El cuidado de los pies es fundamental, y se debe instruir a los pacientes para que realicen una inspección diaria de los pies y del calzado, para evitar que las lesiones pasen desapercibidas por la pérdida del reflejo doloroso5.
La ND es una patología muy prevalente en los pacientes con DM y es una de las causas más frecuentes de lesiones y, por tanto, amputaciones en estos pacientes. El control glucémico estricto ha demostrado evitar el desarrollo de esta patología en pacientes con DM tipo 1 y retrasarla en DM tipo 2. Además, el autocuidado del pie puede sustituir la pérdida del reflejo doloroso en estos pacientes5. Sin embargo, entre el 20% y el 50% de los pacientes desarrollan dolor, cuyo tratamiento estándar actual es farmacológico3 con el apoyo de ciertas medidas no farmacológicas5.

VI JORNADA NACIONAL SOBRE DOLOR INFANTIL

Madrid • 13 junio de 2022
ATENCIÓN AL DOLOR EN NIÑOS, UN DEBER INEXCUSABLE
El pasado 13 de junio de 2022 se celebró en el Hospital Universitario de la Paz en Madrid, la 6ª Jornada Nacional de Dolor Infantil.
Con la premisa: “La atención a los niños y jóvenes con dolor y sus familias: un deber inexcusable”, médicos expertos en Anestesiología, Reanimación Infantil, Cuidados Intensivos Pediátricos, rehabilitadores, psiquiatras, enfermeros y un representante de la Subdirección General de Calidad Asistencial del Ministerio de Sanidad abordaron el desafío que supone el estudio y tratamiento del dolor Infantil en España.
El 20% de los niños en edad escolar presentan dolor crónico, pero solo un 0,2% del presupuesto de investigación se dedica a buscar mejores maneras de tratar el dolor en esta población. Son algunos de los datos que han compartido los expertos en la 6ª Jornada Nacional sobre Dolor Infantil




IASP. LA RELACIÓN CON EL PACIENTE, CLAVE PARA LA INVESTIGACIÓN
La Asociación Internacional para el Estudio del Dolor (IASP) dedica una campaña anual a aplicación de la evidencia científica en la práctica clínica. Sus responsables recuerdan que para avanzar, la investigación necesita incorporar el conocimiento del paciente que se adquiere con la relación establecida en la consulta y el conocimiento de la comunidad en la que vive. La campaña ofrece orientación sobre cómo aplicar en el día a día la nueva evidencia en el campo del dolor.
Heike Rittner y Sulayman Dib-Hajj son los responsables de la campaña anual de la IASP, que este año se dedica a promover la investigación en el campo del dolor y a buscar el modo en el cual ese conocimiento pueda ayudar a quienes viven con esta patología. La campaña incluye talleres, publicaciones específicas, cursos online… y las reflexiones de ambos expertos, que han compartido en un vídeo publicado en la página de la organización en internet.
Ambos hacen hincapié en que es necesario mejorar la investigación y el modo en el cual se habla de ella con los pacientes para ofrecer esperanza en el tratamiento del dolor. La Dra. Rittner recuerda como un giro clave en su carrera de investigadora el hecho de que con su equipo de Berlín pasó de “trabajar sin conexión alguna con los pacientes” a participar en las consultas. Asegura que eso le permitió mejorar sus técnicas en investigación.
“Si hablamos de medicina traslacional, la que permite pasar del ‘conocimiento puro’ a la práctica de la medicina, la caracterización de los pacientes es un paso fundamental; no hay pacientes-tipo en la práctica, y es algo que se aprecia en las consultas, por eso los trabajos experimentales tienen que diseñarse sin olvidar a esos subtipos de pacientes”, apunta. También considera que en algunos casos los ensayos clínicos han fallado por no prestar atención a este aspecto.
Asimismo, ambos destacan que el paciente no es un sujeto aislado, sino que vive en un entorno que es en sí un factor importante para su estado de salud, su evolución y respuesta a los tratamientos. “El médico debe conocer bien tanto al paciente como a su comunidad”, señala el Dr. Dib-Hajj.
MUCHA INVESTIGACIÓN REQUIERE MUCHO ESFUERZO POR APLICARLA
La investigación en el campo del dolor está en un momento álgido. La revista de la IASP, ‘Pain’, ha superado recientemente su propio récord en cuanto a factor de impacto (7,926), el mayor de sus 50 años de historia, pero la investigación que no se traduce en mejorías clínicas no está cumpliendo su función, advierten.
Además de los hallazgos en el área de la genética y las bases fisiopatológicas del dolor, abundan los ensayos clínicos sobre técnicas de diagnóstico más precisas y ajustadas a esos fenotipos diferentes que tanto se aprecian en la práctica clínica. 1, 2
La clasificación de enfermedades ICD-11 se ha actualizado con códigos de diagnóstico precisos para los síndromes dolorosos, y una serie de guías clínicas revisadas recientemente han servido de apoyo en este proceso. En este tipo de estrategias se han incluido, y han tenido un peso específico, los estudios que ayudan a conocer las bases biopsicosociales del dolor y las modalidades de tratamiento interdisciplinares que se han ido poniendo en marcha en diferentes lugares del mundo.
Un grupo de trabajo específicamente designado para la campaña ha preparado material informativo sobre cómo trasladar el conocimiento del dolor a la práctica clínica. Los artículos sobre medicina traslacional publicados en las revistas científicas de la IASP serán de acceso gratuito para todo el mundo. Una parte importante del programa del Congreso Mundial del Dolor, que se celebra en Toronto entre los días 19 y 23 de septiembre, se ocupa de esta cuestión.
Uno de los marcos más empleados para llevar el conocimiento a la práctica (a la que se refieren con las siglas KT, del inglés knowledge translation) es un modelo de acción basado en las conclusiones de numerosas teorías, sintetizadas para conseguir un modelo de colaboración fluido, con interacción entre profesionales, bidireccional y basado en la práctica local, el contexto y la cultura. 3,4
Entre sus recomendaciones, destacan5:
- Implicar a los profesionales de diferentes disciplinas, los pacientes y sus familias en el conocimiento sobre el dolor como parte activa en su aplicación práctica. En este aspecto habrá que adaptar la forma de hablar a cada individuo o grupo, como se hace habitualmente en la consulta.
- Identificar las evidencias que podrán ponerse en práctica, dónde y cómo se hará.
- Identificar las barreras para que esto suceda y buscar soluciones.
- Monitorizar el uso de la evidencia en la práctica, mediante auditorías, por ejemplo.
- Desarrollar herramientas prácticas para comunicar el conocimiento del dolor, en formatos reducidos y fáciles.
CON LAS GUÍAS CLÍNICAS EN MENTE
Clínicos y Autoridades Sanitarias comparten cierta sensación de confusión debido a la creciente generación de evidencia, en ocasiones de calidad variable. Las guías clínicas pueden ser un apoyo importante en este contexto, ya que recomiendan las intervenciones con evidencia sólida y pueden reducir el empleo de aquellas menos eficaces. Pueden ayudar a mejorar la calidad, coherencia y eficacia de la atención a los pacientes. 6
A la hora de ponerlas en práctica, habría que mantener un criterio objetivo, considerando tanto quiénes las han elaborado como si su desarrollo cumplía con los indicadores conocidos de calidad.
¿Y LAS HERRAMIENTAS DIGITALES?
Entre las evidencias más recientes abundan trabajos que respaldan la eficacia de las intervenciones psicosociales en soporte digital para niños, jóvenes y adultos con dolor crónico. La cuestión es que esas intervenciones dependen de la motivación y el compromiso de los pacientes, a su vez estrechamente vinculadas a la calidad de la comunicación con su médico. 7, 8
Estas herramientas pueden ayudar a superar barreras en la atención multidisciplinar, pero es importante considerar cómo optimizar la actitud y la conducta de los pacientes buscando la mejor opción para cada uno, que puede ser apoyo de terapeutas en dispositivos móviles, juegos, apoyo social…
En el abordaje multidisciplinar, se incluyen intervenciones para el manejo de alteraciones del sueño, el peso corporal, el estrés y aspectos sociales que pueden incluirse en las herramientas digitales.
Hay aplicaciones médicas para acompañar a los pacientes, y otros dispositivos que, según recuerda la IASP, “son instrumentos prometedores para hacer que el conocimiento sobre el dolor se aplique en la práctica”. 9

ARTÍCULO
LOS DETECTIVES DEL DOLOR
EL CAMINO A LA CIRUGÍA
Detectives del dolor es una iniciativa de Grünenthal, a través de Dolor.com, para dar a conocer a los investigadores españoles que están en la primera línea de la investigación en dolor. El proyecto está coordinado por el Prof. Dr. Carlos Goicoechea, secretario de la Sociedad Madrileña de Dolor, vicepresidente de la Sociedad Española de Dolor y catedrático de farmacología en la Universidad Rey Juan Carlos, institución que también avala este proyecto.
Mediante una serie de entrevistas a diversos investigadores realizadas por el Prof. Dr. Goicoechea, tanto básicos como clínicos, iremos conociendo la realidad y las aportaciones de la ciencia española al conocimiento del dolor, tanto en su biología como en su diagnóstico y tratamiento.
En este número de Actualidad en Dolor presentamos el último capítulo publicado en esta serie: “El camino a la cirugía”. En el webinar, la Dra. Carmen Solanes, ingeniera biomédica de la Universidad Politécnica de Valencia, aclara conceptos sobre la estimulación de la médula espinal, los retos que plantean las intervenciones de implantación de estos dispositivos y el uso futuro de los modelos computacionales adaptados al paciente para el tratamiento del dolor crónico.
La Dra. Solanes presenta los resultados más interesantes obtenidos con un modelo tridimensional de la médula espinal personalizado de los pacientes, que puede predecir la evolución de la implantación de electorestimuladores, confirmando la utilidad de estos modelos tridimensionales para mejorar el resultado de estas intervenciones. El alto coste de su generación hace que se busque simplificar estos modelos, y la Dra. Solanes explica algunas estrategias para conseguirlo.
También describe cómo se generan los modelos tridimensionales a partir de resonancias magnéticas de los pacientes y mediante el uso de programas informáticos especializados.
Otro aspecto clave de su intervención es el análisis de las posibles aplicaciones de la ingeniería biomédica en el estudio y el control del dolor.
En una segunda parte, el Dr. Antonio Montes, responsable de la Unidad de Dolor del Hospital del Mar, y Profesor de la Universidad Pompeu y Fabra, revisa las líneas de investigación de su grupo en el ámbito de la cronificación del dolor postquirúrgico. Explica la determinación del riesgo previo a la cirugía de un paciente para el desarrollo de dolor crónico postquirúrgico, las medidas de prevención que pueden ser útiles en los pacientes de mayor riesgo y la aplicación de tratamientos farmacológicos o intervencionistas para paliar este problema.
En el terreno de la prevención de la cronificación a largo plazo del dolor postquirúrgico, el Dr. Montes habla del modelo de 6 factores clínicos desarrollado por su grupo, que permite establecer con exactitud el riesgo previo a la cirugía que presenta cada paciente de desarrollar dolor crónico postquirúrgico. Esto permitirá personalizar las medidas de prevención en función del riesgo de cada paciente. Los factores clínicos analizados son de fácil evaluación, lo que permite que el modelo sea aplicable en la práctica clínica habitual. El Dr. Montes comenta la importancia de la intervención sobre los factores psicosociales del paciente. En este aspecto, el especialista considera que el catastrofismo del paciente es clave para predecir el riesgo de cronificación.
En cuanto a la adaptación de la anestesia al riesgo del paciente, el Dr. Montes considera que lo ideal es el uso de un balance adecuado de fármacos analgésicos que permitan controlar el dolor postquirúrgico.
La parte final del webinar es un diálogo entre los participantes acerca de diversos aspectos de posibles desarrollos futuros de sus respectivos campos de investigación: uso del big data, utilidad de los monitores de nocicepción (dispositivos que monitorizan parámetros indirectos de nocicepción durante las intervenciones quirúrgicas), aplicación de la Inteligencia Artificial y la posible evolución de sus investigaciones.

ARTÍCULO
DEL REPOSO AL EJERCICIO:
EL MANEJO ACTUAL DEL DOLOR LUMBAR
Se calcula que el 7,3% de la población mundial vive afectada por el dolor lumbar y por la pérdida de funcionalidad que ocasiona. En los países desarrollados como EEUU, el problema podría afectar a un 10% de la población adulta1. Se trata de un trastorno común que puede comenzar en la adolescencia hasta el punto de que alrededor de un 40% de las personas de entre 9 y 18 años refiere haber tenido dolor lumbar2.
Alrededor de un 40% de las personas de entre 9 y 18 años refiere haber tenido dolor lumbar, siendo esta la primera causa de incapacidad en todo el mundo.
Actualmente, este problema va al alza en los países de bajos y medios ingresos, lo que convierte al dolor lumbar en la primera causa de incapacidad a nivel mundial2. Se trata, por tanto, de una urgente preocupación global2.
Con frecuencia, el dolor lumbar indica la presencia de otras enfermedades (tumores, fracturas vertebrales, infecciones o alteraciones inflamatorias como la espondiloartritis), aunque en la mayoría de los casos no se encuentra su causa2. En estos el dolor es designado como “inespecífico”. Se caracteriza por un amplio rango de alteraciones biofísicas, psicológicas y sociales que reducen la funcionalidad, la sociabilidad, incluso la prosperidad personal2.
En la práctica clínica, el dolor lumbar inespecífico que dura menos de seis semanas se clasifica como “agudo” y el 90% suele ser autolimitado y resolverse entre seis y ocho semanas. Cuando persiste entre seis semanas y tres meses se clasifica como “subagudo” y si dura más de tres meses hablaríamos de dolor lumbar “crónico”. Sin embargo, algunos autores consideran que en realidad la mayoría de los pacientes sufren de episodios intermitentes de duración variable3.
FACTORES PSICOSOCIALES
Existen estudios que intentan establecer la relación entre algunos factores psicosociales y los resultados clínicos de los pacientes con dolor lumbar4. Por ejemplo, un trabajo realizado con 472 enfermos que completaron un cuestionario sobre factores psicosociales, características del dolor lumbar y limitación de la funcionalidad mostró interesantes conclusiones. Los participantes con catastrofismo tenían una probabilidad 2,21 veces superior de padecer dolor intenso y 2,72 veces mayor probabilidad de ver limitada su funcionalidad. En cuanto al descanso y al movimiento, los participantes con creencias erróneas sobre el reposo tenían una probabilidad 2,75 veces mayor de sufrir dolor intenso y 1,72 veces mayor de ver limitada su funcionalidad. Los pacientes con quinesiofobia (kinesiofobia), por su parte, presentaron una probabilidad 3,34 veces superior de sufrir dolor lumbar intenso y de 1,98 veces superior de ver limitada su funcionalidad4.
Los pacientes que creen que “el dolor de espalda necesita reposo” tienen más probabilidad de sufrir dolor intenso y ver limitada su funcionalidad4.
Estos resultados sugieren que el sedentarismo podría estar relacionado con el dolor lumbar. Un meta-análisis sistemático que analizó 16 estudios sobre sedentarismo y dolor lumbar intentó aclarar esta cuestión. Según este análisis, periodos diarios de sedentarismo de 3 a 6 horas, de 6 a 8 horas o superiores a 8 horas no estaban relacionados con el desarrollo de dolor lumbar, sin embargo, en los pacientes que ya lo padecen, bastan 3 horas diarias de actitud sedentaria para empeorar el dolor lumbar y la discapacidad relacionada5.
EVITAR EL REPOSO
En el pasado, se realizaron multitud de trabajos dirigidos a dilucidar si el reposo en cama era beneficioso para el tratamiento del dolor lumbar, y si era incluso mejor que la recomendación de realizar ejercicio. Se demostró que la distensión lumbar tenía mayor probabilidad de repetirse y de convertirse en crónica en los pacientes que reposaban para aliviar su dolor lumbar agudo6. También resultó evidente que el reposo en cama prolongado en las fases tempranas del dolor lumbar agudo, se asocia con niveles más altos de discapacidad a largo plazo7 además de otros efectos nefastos, como la pérdida de la condición física y dificultades en la rehabilitación socio-profesional8.
Otros trabajos confirmaron que en los pacientes con dolor lumbar agudo, continuar con las actividades ordinarias, dentro de los límites permitidos por el dolor, conlleva una recuperación más rápida que el reposo en cama o los ejercicios de movilización de la espalda9. Todos estos hallazgos conforman una fuerte evidencia que sugiere que el reposo en cama no es efectivo en el manejo del dolor lumbar agudo10.
Las guías actuales de manejo del dolor lumbar en atención primaria desaconsejan el reposo en cama. Un meta-análisis que revisaba diversas guías europeas de diagnóstico y tratamiento del dolor lumbar inespecífico en atención primaria, analizó las principales recomendaciones para dolor lumbar agudo y crónico11.
Para el tratamiento de los pacientes con dolor lumbar agudo, el 64% de las guías recomendaban evitar el reposo en cama, mientras que el resto de guías lo desaconsejaban para cualquier duración de los síntomas. El 58% de las guías también aconsejaban que los pacientes con dolor lumbar agudo mantuvieran sus actividades normales, y el 42% daban el mismo consejo para cualquier duración de los síntomas11.
Este meta-análisis concluye que el consenso actual recomienda la educación de los pacientes, ofrecer la seguridad de un pronóstico favorable, aconsejar el regreso a las actividades normales y evitar el reposo en cama, todo ello en combinación con el tratamiento farmacológico adecuado11. Además, en el caso de dolor lumbar crónico, se debe prescribir terapia física11.
EL COMPROMISO DE LOS PACIENTES
Las creencias de los pacientes y su colaboración son importantes, como demostró un estudio transversal realizado en Alemania con 977 personas que padecían dolor lumbar. El objetivo del trabajo era evaluar el grado de aceptación por parte de los pacientes del componente psicosocial del dolor lumbar y su coincidencia con las guías alemanas12.
Un grupo significativo de pacientes no estaba de acuerdo con el abordaje psicosocial del dolor lumbar12. Los factores que influyeron en este punto de vista fueron: la severidad del dolor, el estado general de salud, el nivel educativo y la experiencia de tratamientos previos12. Los pacientes con niveles de educación más altos, peor situación de salud, dolor lumbar más intenso y que no habían recibido tratamiento en los últimos 12 meses, se sentían más inclinados a aceptar un diagnóstico psicosocial y a contemplar las técnicas de relajación como potencialmente útiles, algo que no ocurría si los pacientes tenían menor nivel educativo12.
La motivación de los pacientes para comprometerse con un programa de ejercicios es siempre un problema. Sobre todo, en los adultos mayores, en los que la probabilidad de que sigan la recomendación es la mitad que la de los adultos jóvenes. Con frecuencia, los mayores encuentran dificultades para acceder a programas de ejercicios accesibles, cómodos y estimulantes13. Varios estudios cualitativos han revelado que la ausencia de guía profesional, la falta de información y una participación limitada en programas de actividad física son las principales barreras para que los adultos mayores adopten programas de ejercicio para el dolor lumbar13.
Un estudio realizado en pacientes mayores de 65 años con dolor lumbar y comorbilidades, que pretendía analizar la utilidad de un programa de ejercicios que tuviera en cuenta las comorbilidades, mostró interesantes hallazgos. Por ejemplo, que los programas de ejercicios para adultos jóvenes no son aplicables a adultos mayores con dolor lumbar y comorbilidades. También que es posible crear un programa de ejercicios seguro, aceptable y que tenga en cuenta las principales discapacidades de los adultos mayores13.
Estos trabajos llaman la atención sobre la importancia de un buen asesoramiento de los pacientes sobre los factores psicosociales y de la necesidad de programas de ejercicio adecuados a las limitaciones de la edad y las comorbilidades13.
¿QUÉ TIPO DE EJERCICIO?
El dolor lumbar puede reducir la funcionalidad física y la capacidad para realizar las tareas de la vida diaria, impactando en la percepción de la calidad de vida relacionada con la salud14. Esta se relaciona con la sensación de bienestar en áreas como la salud física, el estado psicosocial, el nivel de autonomía e independencia, las relaciones sociales y las creencias14. Muchos autores sugieren que la realización de actividad física estructurada junto con ejercicios terapéuticos podría prevenir el dolor musculoesquelético, mejorando la funcionalidad e impactando positivamente en la calidad de vida14.
Las terapias físicas para el dolor lumbar más frecuentemente analizadas en la literatura incluyen estiramientos, masajes terapéuticos, ejercicios terapéuticos y programas educativos. Es más, las intervenciones más efectivas son las que combinan estas técnicas. Un estudio que comparó un programa de ejercicios y masajes terapéuticos junto con un programa educativo, frente a ejercicios terapéuticos estandarizados y un programa educativo, comprobó que ambas estrategias conseguían reducir el dolor lumbar inespecífico en adultos mayores, mejorando su calidad de vida relacionada con la salud14.
Otra terapia recomendada con frecuencia para el tratamiento del dolor lumbar inespecífico es el yoga. Éste ha demostrado reducir el dolor y mejorar la funcionalidad en estos enfermos1,15. Un meta-análisis que evaluó 18 estudios aleatorizados y controlados que analizaban la eficacia del yoga en el dolor lumbar, demostró que esta disciplina tenía el mismo efecto sobre el dolor y la discapacidad que cualquier otro programa de ejercicios o terapia física1. En concreto, el yoga reduce el dolor en el corto y medio plazo, mientras que mejora la funcionalidad desde el corto al largo plazo1.
Otro trabajo explica que el yoga mejora la percepción de los movimientos físicos, reduce los niveles de estrés, la severidad del dolor y mejora la regulación de las emociones. Este mismo estudio apunta que esto se conseguiría porque la práctica del yoga induce la expresión de algunos genes antisentido que producen cambios moleculares favorables en dolor lumbar15.
La literatura también ha analizado la utilidad del pilates en este contexto. Mientras algunos estudios encuentran que su eficacia es similar a la de otros programas de ejercicio físico16, otros concluyen que esta disciplina, junto con la terapia McKenzie y la restauración funcional son los más efectivos para reducir el dolor y mejorar la funcionalidad17.
Un análisis publicado en la revista del Colegio de Médicos Generales Australianos, que revisó la evidencia de los diversos tipos de terapias físicas para la mejora del dolor y la funcionalidad en dolor lumbar, nos ofrece una clasificación de estas terapias en función de su eficacia. En este trabajo se explica que el pilates, aerobic y los ejercicios de resistencia y control motor consiguen una reducción significativa de la intensidad del dolor. El estudio utiliza una escala analógica visual de 100 puntos para evaluar la reducción del dolor clínicamente significativa (mayor a 20 puntos), según esta escala, y con una evidencia de nivel 1, el pilates conseguiría una reducción de la intensidad del dolor de 37 puntos, el aerobic de 28 puntos, los ejercicios de estabilización y control motor de 26 y los de resistencia de 2318 (Figura 1). Dado el rango de modalidades de ejercicio que pueden reducir el dolor de manera clínicamente significativa, parece que ninguna clase de ejercicio es superior. Se consideran óptimas las terapias activas en las que los pacientes son animados a realizar ejercicio de manera progresiva18.
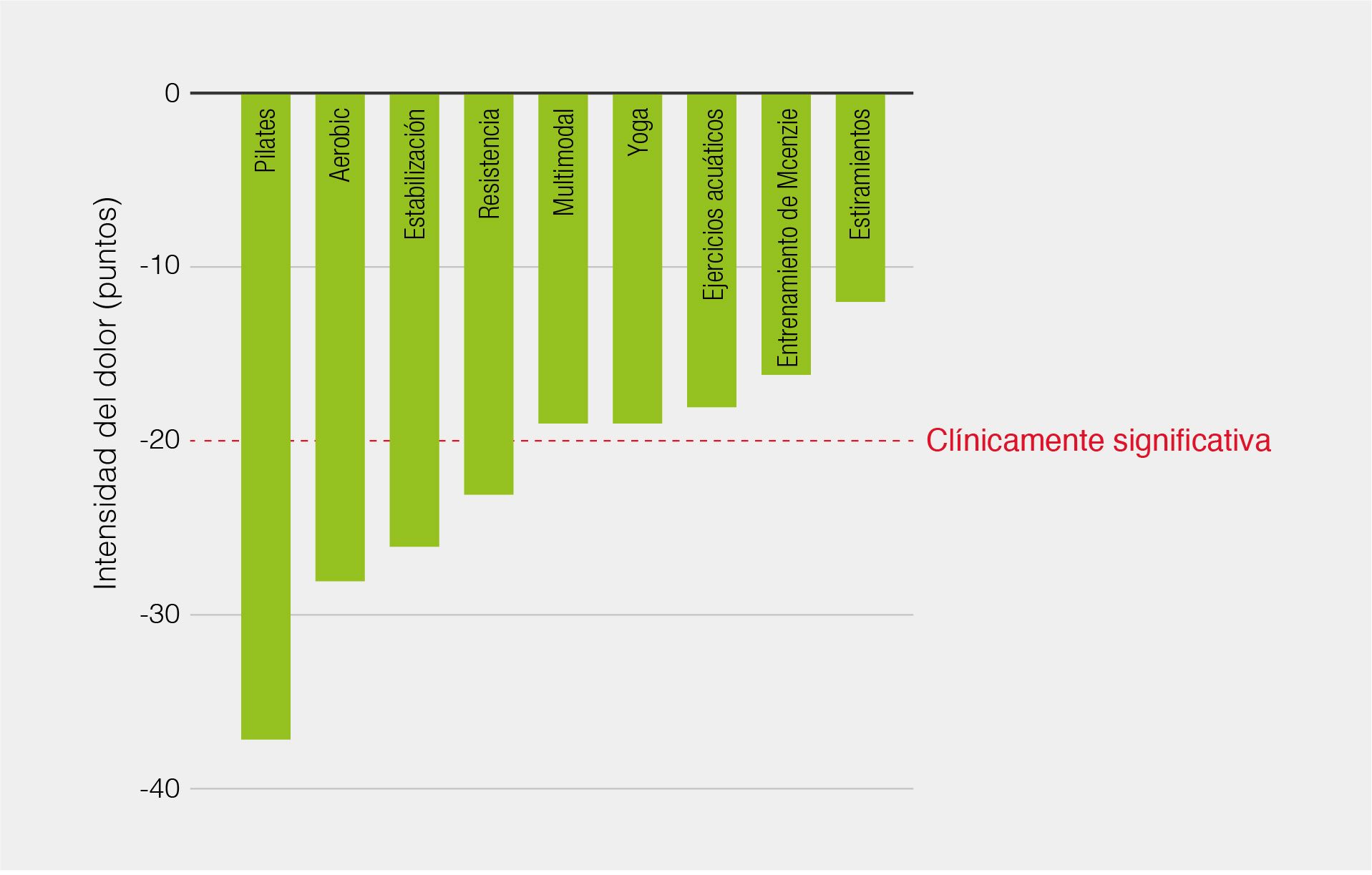
Figura 1. Efectos de las modalidades de entrenamiento físico en la intensidad del dolor. Adaptada de Owen PJ, 202118
En cuanto a la reducción de la discapacidad (mejora subjetiva de la funcionalidad física), el estudio utiliza una escala muy usada en la evaluación de la discapacidad en este tipo de pacientes, el Oswestry Disability Index (Índice de discapacidad de Oswestry). El trabajo muestra que, con un nivel de evidencia 1, los ejercicios de resistencia consiguen una reducción clínicamente significativa de la discapacidad subjetiva de 11 puntos, de 14 puntos para los ejercicios de estabilización y control motor, 12 puntos para los ejercicios acuáticos y 11 para el yoga y el Pilates18 (Figura 2). Dado que el pilates y los ejercicios de resistencia y estabilización y control motor son capaces de reducir tanto la intensidad del dolor como la discapacidad, estas modalidades de entrenamiento parecen las más prometedoras para el manejo del dolor lumbar inespecífico18.
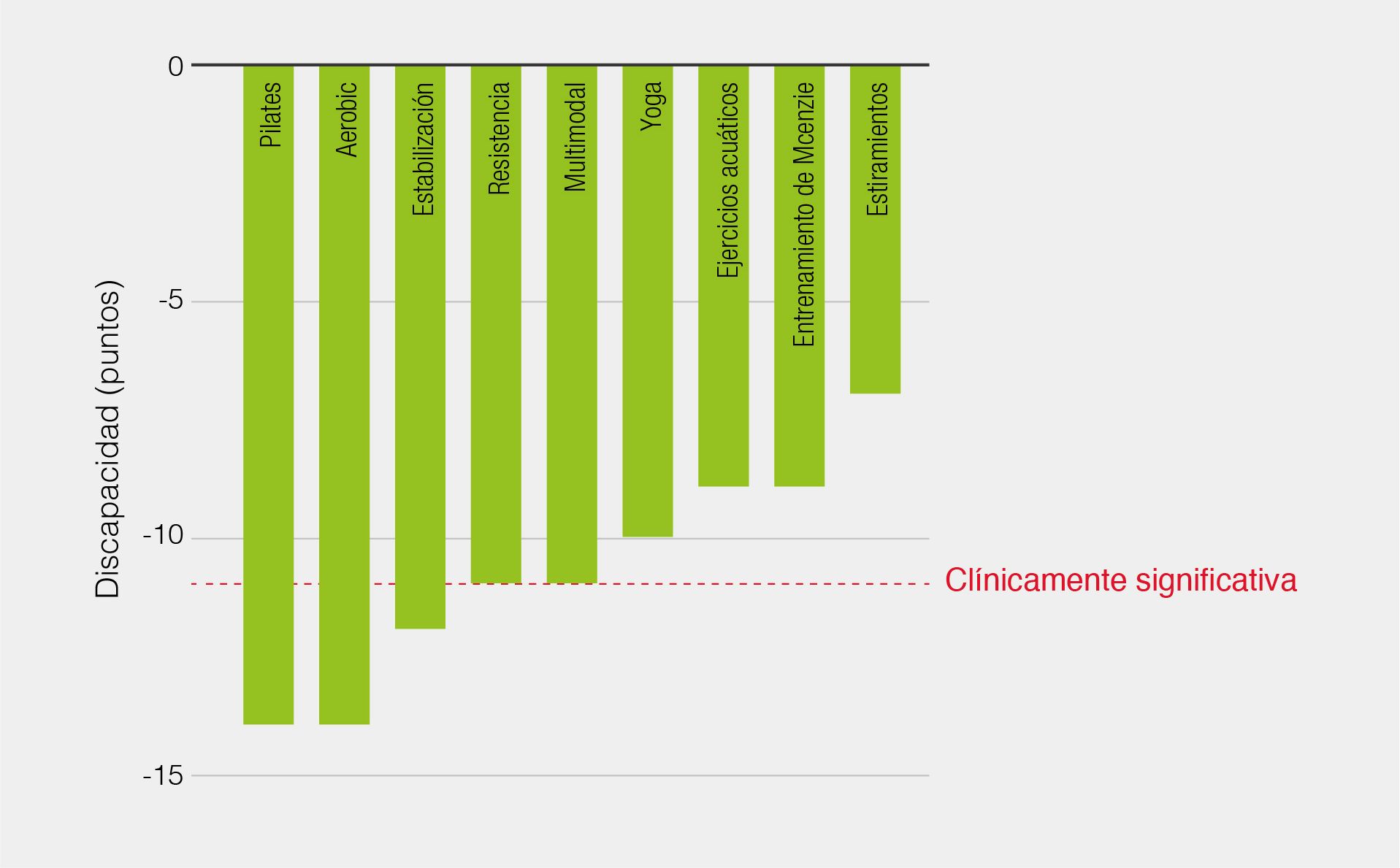
Figura 2. Efectos de las modalidades de entrenamiento físico sobre la discapacidad.
Adaptada de Owen PJ, 202118
Los científicos también han evaluado la acupuntura y la Terapia Cognitivo Funcional para el tratamiento del dolor lumbar, pero las evidencias son aún escasas19,20.
El dolor lumbar es una preocupación global. Hoy en día está admitido que su tratamiento debe incluir algún tipo de terapia física, superada ya la creencia de la necesidad de reposo. Existen multitud de propuestas de programas de ejercicio, y algunos datos apuntan a que algunas pueden ser preferibles a otras según las circunstancias. Sin embargo, las evidencias no son concluyentes, por lo que la decisión del programa de ejercicios debería basarse en las preferencias y capacidades de los pacientes y en los posibles costes.








Más allá del dolor
ENFERMEDADES RARAS
LA DISTROFIA MUSCULAR DE DUCHENNE

La distrofia muscular de Duchenne (DMD) es una enfermedad grave y progresiva que causa pérdida muscular. Los síntomas más tempranos comienzan a los 2 o 3 años con frecuentes caídas, alteraciones de la deambulación y dificultades para subir escaleras1. La debilidad muscular progresiva que se presenta al inicio de la infancia, dará paso a complicaciones musculoesqueléticas, respiratorias y cardiacas que ocasionan discapacidad, dependencia y muerte prematura2. La mayoría de los pacientes necesitarán silla de ruedas a los 10 o 12 años y ventilación asistida a los 20. Con una atención óptima, los enfermos vivirán hasta los 20-40 años, pues su vida estará limitada por los fallos cardíacos o respiratorios1. También es frecuente la disfunción neurocognitiva que, aunque no es progresiva, tiene un gran impacto en la capacidad de aprendizaje y en la calidad de vida2.
Se trata de una enfermedad genética recesiva ligada al cromosoma X con una prevalencia mundial aproximada de 0,5 casos por cada 10.000 varones2. Esto se traduce en unos 1.000 casos en España y 12.500 en la Unión Europea, siendo la miopatía más frecuente en niños2. La DMD es extremadamente rara en mujeres (<1 por millón) y se limita a casos con síndrome de Turner1.
Distrofina disfuncional
La DMD se debe a mutaciones en el gen de la distrofina, que se localiza en el cromosoma X. Existen miles de diferentes mutaciones que afectan a este gen (reordenamientos, deleciones, duplicaciones, mutaciones de un solo nucleótido, inserciones y mutaciones “non-sense”)1,2. Independientemente del tipo de mutación, se produce un cambio en el marco de lectura del ARN mensajero de la distrofina que produce una proteína no funcional1.
La distrofina es una proteína sub-sarcolémica imprescindible para la estabilidad estructural del músculo3. El sarcolema es la membrana de la célula muscular o miocito, y la distrofina interacciona tanto con la membrana como con componentes del citoplasma (microfilamentos de actina, filamentos intermedios, microtúbulos y otras estructuras proteicas relacionadas con la estabilidad y la contracción muscular)1. Al conjunto de la distrofina y las proteínas con las que se une en el miocito se llama Complejo de Proteínas Asociadas a Distrofina (CPAD)1. Cuando la distrofina es disfuncional debido a las mutaciones, el CPAD se desensambla y se producen alteraciones en la estabilidad muscular y la contractilidad, provocando un amplio rango de consecuencias en las funciones de los músculos1 y desencadenando una grave degeneración muscular progresiva2.
Existen mutaciones más leves, como la distrofia muscular de Becker (DMB) en las que hay niveles bajos de distrofina y los pacientes pueden caminar más allá de los 16 años. Entre la DMB y la DMD hay muchas variantes, algunas afectan sólo al corazón, y otras progresan con muy pocos síntomas, incluso sin ellos2.
También existen mujeres portadoras de la enfermedad, que presentan la mutación en uno de sus cromosomas X1. Generalmente son asintomáticas, pero en algunos casos, alrededor del 10%2, pueden presentar un cuadro similar a la DMB1. La sintomatología es siempre más leve y con frecuencia sólo afecta al ámbito cognitivo o al corazón2.
Fase ambulatoria y no ambulatoria
La sintomatología comienza alrededor de los 3 años (caídas frecuentes, caminar con los dedos de los pies, dificultad para subir escaleras…). Es característico el signo de Gowers: los niños trepan con sus manos por sus piernas para conseguir la posición erecta2. El desarrollo motor es favorable hasta los 4-6 años, momento en que se detiene y el niño empieza a perder habilidades ya adquiridas2. Comienza una fase en la que las dificultades de movimientos y el inicio del tratamiento con corticoides producen un aumento de peso y de riesgo de osteoporosis, con mayor frecuencia de fracturas2. Entre un 20-34% de los pacientes presentan discapacidad intelectual, síntomas del espectro autista o diferentes alteraciones del comportamiento cognitivo2.

En la mayoría de los casos, los enfermos pierden la capacidad de andar a los 12-14 años, y el 90% presenta escoliosis debida a la debilidad de los músculos paraespinales. Todo esto causa complicaciones ortopédicas y dificultad respiratoria (sobre todo durante el sueño) que causa cefaleas matutinas, náuseas, fatiga, pérdida de apetito y discapacidad cognitiva. La dificultad respiratoria fue la principal causa de muerte en estos pacientes, aunque los avances en los sistemas de respiración asistida han desplazado la mortalidad a causas cardiacas2.
Un diagnóstico genético preciso es fundamental
El diagnóstico debe realizarse lo más temprano y precisamente posible, para establecer rápidamente una intervención adecuada2. La DMD debe sospecharse en varones de 2-4 años con retraso en el desarrollo motor, debilidad muscular, pantorrillas hipertróficas y signo de Gowers1. También si hay discapacidad cognitiva y retraso en el habla, ya que el 30% de los pacientes presentan estos síntomas1. Lo primero es evaluar la creatina kinasa (CK) que en la DMD tiene unos niveles entre 10 y 100 veces más altos que la normalidad1,2. En estos casos el diagnóstico debe confirmarse mediante test genéticos.
En el 85-90% de los casos es suficiente la realización de MLPA (multiplex ligationdependent probe amplification) que permite detectar deleciones y duplicaciones. Para las mutaciones puntuales, que suponen un 10-15%, es necesario la secuenciación directa del gen DMD o la secuenciación del exoma (la parte del gen que codifica directamente la distrofina)1,3.
La identificación precisa de la mutación puede determinar si el paciente es candidato a las terapias dirigidas que hay aprobadas en algunos países o que están en investigación1. También es importante la evaluación genética de la madre portadora, para emitir un consejo genético, si es necesario1.
Si los test genéticos son negativos, pero el paciente muestra signos de DMD y CK muy elevada, puede ser necesario realizar una biopsia muscular2. Ésta permite detectar signos de distrofia: necrosis, signos de regeneración muscular y la ausencia total de distrofina en la DMD, o parcial en la DMB. También permite detectar otras distrofinopatías3.
El cribado neonatal se dirige a patologías de inicio neonatal para las que un tratamiento temprano presenta fuertes evidencias de cambiar el pronóstico. Aunque esto no es así con la DMD, muchos grupos están a favor de su inclusión en el cribado neonatal, ya que un diagnóstico temprano permitiría la aplicación de las nuevas terapias en desarrollo, que podrían ser más efectivas si se aplican en etapas iniciales, antes de que se produzca un daño muscular irreversible1.
Mejoras en los últimos 30 años
Lamentablemente, a día de hoy no existe cura para la DMD1–3, aunque la supervivencia de estos pacientes ha mejorado muchísimo en los últimos años. Un estudio realizado en Francia demostró que la esperanza de vida era de 25,77 años para los nacidos antes de 1970 y de 40,95 para los nacidos después1. Esto se ha debido al manejo de medidas sintomáticas multidisciplinares, que son capaces de modificar favorablemente el curso de la enfermedad1,2.
El tratamiento se orienta a la prevención de complicaciones tempranas como la escoliosis, las retracciones asimétricas y la insuficiencia cardíaca y respiratoria3. El uso de corticoides ha demostrado prevenir la escoliosis y prolongar la marcha, desde los 12 años sin ellos a los 14-16 con su uso3.
Debe realizarse una evaluación respiratoria cada 6 meses tras la pérdida de la capacidad ambulatoria, ya que la mejora en estos cuidados ha demostrado aumentar la esperanza de vida1. Sin embargo, con las mejoras respiratorias, la causa de muerte se ha desplazado a problemas cardíacos como la insuficiencia cardíaca congestiva, arritmias y riesgo de muerte súbita1. La detección temprana de estos problemas permite usar tratamientos cardioprotectores (Inhibidores de la ECA y beta-bloqueantes), desde los 10 años, para intentar retrasar la aparición de patologías cardíacas.
En cuanto a los problemas ortopédicos, se busca prevenir el debilitamiento del músculo y la aparición de deformidades severas como contracturas o escoliosis1. Los cuidados endocrinológicos se orientan al manejo de los problemas de crecimiento, la salud ósea, el metabolismo de las grasas y la glucosa y el retraso de la pubertad, todos ellos manejados con protocolos estándar para estos casos1.
Los síntomas digestivos se gestionan con ranitidina o inhibidores de la bomba de protones. Mientras que también hay que prestar atención a problemas urológicos, que pueden abarcar desde reducción de capacidad vesical hasta disinergia del esfínter detrusor. Muchos de ellos se pueden manejar farmacológicamente. Además, puede aparecer disfunción renal, que debe ser manejada por un nefrólogo1.
Desde el punto de vista psicológico, debe estarse atento a los problemas de neurodesarrollo y a la aparición de discapacidad cognitiva, TDAH, alteraciones del espectro autista, ansiedad y trastornos obsesivo-compulsivos1.
La investigación y la terapia génica
Los avances terapéuticos pueden dividirse en dos grupos. Primero estarían los que no dependen de la mutación y que se dirigen a la inflamación, la capacidad de regeneración muscular, la estabilización de la membrana muscular, expresión de proteínas compensatorias como la utrofina, antioxidantes…, al no ser específicas de la mutación, podrían beneficiar a cualquier paciente3. En este grupo aún no hay fármacos aprobados, salvo los corticoides3.
Un segundo grupo es la conocida terapia dirigida o medicina personalizada, con fármacos específicos de determinadas mutaciones, y sólo útiles en los pacientes que las presentan3.
El primero de estos medicamentos es el atalureno, que restaura el marco de lectura del ARNm de la distrofina, permitiendo la producción de una proteína normal. Está aprobado por la EMA para pacientes que tengan una mutación puntual sinsentido primaria y ha demostrado una ralentización de la pérdida de metros en el test de marcha de seis minutos3.
Otra aproximación es la terapia de reemplazo de genes, que intenta introducir en el organismo un gen funcional de distrofina para producir proteína normal. Sin embargo, el gen de la distrofina es de gran tamaño, y no “cabe” en los virus (vectores), generalmente adenovirus, que se usan para introducirlos en las células (miocitos). Para resolverlo, se han creado genes que producen proteínas más pequeñas, pero con la misma funcionalidad: son las llamadas mini y microdistrofinas. Su uso en modelos animales ha demostrado la reversión de los síntomas, de los cambios distróficos en la fibra muscular y una considerable reducción de la CPK sérica. Estos datos ha impulsado la realización de ensayos clínicos3.
Otra alternativa es la producción de una proteína parcialmente funcional mediante la técnica llamada salto del exón. Ésta introduce una molécula pequeña de ARN en el miocito que hace que la producción de la distrofina no se interrumpa al llegar a la mutación, aunque la secuencia estará incompleta3. Dentro de este grupo están en marcha ensayos clínicos con eteplirsen, casimersen y golodirsen, cada uno dirigido a una mutación en un exón diferente, aunque su eficacia es de corta duración y deben administrase semanalmente, además, no son bien captados por el corazón1,3.
Para resolver estos problemas se está investigando la restauración del gen mediante la técnica del CRISPR, que logra eliminar de forma permanente la mutación-deleción del gen de la distrofina. Su ensayo en modelos animales ha demostrado la restauración de la distrofina funcional, tanto en músculos esqueléticos como cardiaco, sus resultados son similares a los obtenidos con la técnica anterior, pero con una corrección permanente del gen DMD mutado sin necesidad de tratamiento repetido3.
El tratamiento fundamental para la DMD es la suplementación o recuperación de la distrofina mediante el uso de vectores virales3. Mientras se llega a la cura definitiva de la DMD es fundamental que los pacientes y sus familias reciban la atención recomendada en las guías médicas de manejo de DMD en cada una de las etapas de la enfermedad3.
Bibliografía
- Duan D, Goemans N, Takeda S, Mercuri E, Aartsma-Rus A. Duchenne muscular dystrophy. Nat Rev Dis Primers. 2021;7(1):13. doi:10.1038/s41572-021-00248-3
- Nascimento Osorio A, Medina Cantillo J, Camacho Salas A, Madruga Garrido M, Vilchez Padilla JJ. Consensus on the diagnosis, treatment and follow-up of patients with Duchenne muscular dystrophy. Neurologia (Engl Ed). 2019;34(7):469-481. doi:10.1016/j.nrl.2018.01.001
- Ortez C, Natera de Benito D, Carrera García L, Expósito J, Nolasco G, Nascimento A. [Advances in the treatment of Duchenne muscular dystrophy]. Medicina (B Aires). 2019;79 Suppl 3:77-81.





GUÍA FUNCIONALIDAD
Recomendaciones para la funcionalidad en pacientes con dolor crónico


CURSO ONLINE EN DOLOR CRÓNICO
GENERALIDADES Y TRATAMIENTOS
Acreditado con 11 Créditos ECMECS | Dirigido a: Médicos, enfermería y auxiliar de enfermería

Información sobre el curso
- El dolor crónico es una enfermedad infravalorada e infratratada, pese a que deteriora enormemente la calidad de vida de las personas que lo padecen.
- Este curso que versa sobre generalidades y tratamientos en dolor crónico cuenta con diez doctores del Hospital de la Santa Creu i Sant Pau.
- La finalidad de este curso es la de aumentar el conocimiento de los profesionales médicos en el tratamiento del dolor crónico para así mejorar la atención y los cuidados a los pacientes que lo padecen.

Congresos y jornadas
Consulte todos los congresos, jornadas, eventos y reuniones especializados en dolor.





